题目内容
9.下表所示的五种元素中,W、X、Y、Z为短周期元素,X元素的单质是空气中含量最多的成分.下列说法正确的是( )| X | Y | ||
| W | Z | ||
| T |
| A. | X位于元素周期表中第二周期ⅤA族 | |
| B. | Y、Z形成氢化物的沸点更高是Z | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | 元素T与X的原子序数相差25 |
分析 X元素的单质是空气中含量最多的成分,则X为N元素,由元素在周期表中的相对位置,可知Y为O元素、Z为S、W为Si、T为Ge,据此解答.
解答 解:X元素的单质是空气中含量最多的成分,则X为N元素,由元素在周期表中的相对位置,可知Y为O元素、Z为S、W为Si、T为Ge.
A.X为N元素,位于元素周期表中第二周期ⅤA族,故A正确;
B.Y、Z形成氢化物分别为水、硫化氢,水分子之间存在氢键,沸点高于硫化氢,故B错误;
C.由N、O和氢三种元素可以形成硝酸、硝酸铵等,硝酸只有共价键,而硝酸铵含有共价键、离子键,故C错误;
D.元素T的原子序数为32,X元素原子序数为7,二者原子序数相差25,故D正确;
故选:AD.
点评 本题考查位置结构性质关系,推断元素是解题关键,注意对元素周期律的理解掌握,理解同主族元素元素序数关系,难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
19.下列关于电化学的叙述正确的是( )
| A. | 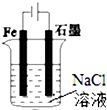 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红 | |
| B. | 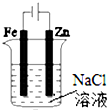 图②装置可以验证牺牲阳极的阴极保护法 | |
| C. |  图③可以模拟钢铁的吸氧腐蚀,铁棒一极的电极反应式:Fe=Fe 2++2e- | |
| D. | 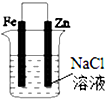 分别给上述4个装置的铁电极附近滴加少量K3[Fe(CN)6]溶液,②④出现蓝色沉淀 |
17. 乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
 乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )| A. | 与金属钠作用时,键①断 | |
| B. | 浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和④断裂 |
4.图为实验室从海带中提取碘单质的流程示意图,判断下列说法错误的是( )
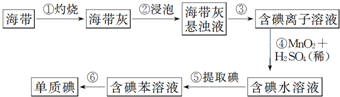

| A. | 步骤①需要用到蒸发皿 | B. | 步骤③需要过滤装置 | ||
| C. | 步骤⑤需要用到分液漏斗 | D. | 步骤⑥需要蒸馏装置 |
14.下列化合物中,含有极性共价键的离子化合物是( )
| A. | Ca(OH)2 | B. | N2H4 | C. | Na2S2 | D. | NH4NO3 |
18.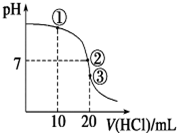 常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )
常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )
 常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )
常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| C. | ①、②、③三点所示的溶液中水的电离程度②>③>① | |
| D. | 滴定过程中不可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol甲基中含有的电子数为10NA | |
| B. | 1mol乙醇中含有C-H键的数目为6NA | |
| C. | 300mL2mol/L乙醇水溶液中所含H原子数为3.6NA | |
| D. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
 工业上研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:
工业上研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是: