题目内容
【题目】(1)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量为______、______、________
(2)在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为_________。
(3)一种不纯的铁,已知它含有铜、铝、镁等一种或几种金属杂质,5.6g这样的铁跟足量的稀H2SO4作用,生成H2 2.24L(标准状况),则此铁块中一定含有的金属杂质是____ 。
【答案】0.64mol 0.02mol 0.24mol 16:9 Cu
【解析】
(1)从溶液中离子守恒的物质的量守恒的角度进行计算,依据溶液中各离子的物质的量相等配制。
(2)根据化学方程式和已知条件“R和M的相对分子质量之比为22:9”以及R的质量,列出比例式,即可求出M的质量;根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。则生成的Y的质量=R的质量+M的质量﹣X的质量,然后写出两者的比即可。
(3)如果Fe是纯铁,根据转移电子守恒知,5.6gFe与足量稀硫酸反应生成n(H2)=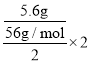 =0.1mol,生成氢气在标况下体积=0.1mol×22.4L/mol,则杂质中金属平均相对原子质量为56,且有能和酸反应生成氢气的、也有和酸不反应的,据此分析解答。
=0.1mol,生成氢气在标况下体积=0.1mol×22.4L/mol,则杂质中金属平均相对原子质量为56,且有能和酸反应生成氢气的、也有和酸不反应的,据此分析解答。
(1)0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4中 n(NH4+)=n(NH4Cl)=0.5mol;n( Cl﹣ )=n(NH4Cl)+n( KCl)=0.5mol+0.16mol=0.66mol;n( K+ )=n( KCl)+2n( K2SO4)=0.16mol+2×0.24mol=0.64mol;n(SO42﹣)=n( K2SO4)=0.24mol;用KCl、NH4Cl、(NH4)2SO4配制,则:
n((NH4)2SO4)=n(SO42﹣)=0.24mol;
n( KCl)=n( K+ )=0.64mol;
n(NH4Cl)=n( Cl﹣ )﹣n( KCl)=0.66mol﹣0.64mol=0.02mol;
(2)根据已知条件“R和M的相对分子质量之比为22:9”,则R:2M=22:(2×9)=22:18,设生成的M的质量为a,则22:18=4.4g:a,解之得:a=3.6g;
根据质量守恒定律可得Y的质量=4.4g+3.6g﹣1.6g=6.4g;此反应中Y和M的质量比是6.4g:3.6g=16:9。
(3)如果Fe是纯铁,根据转移电子守恒知,5.6gFe与足量稀硫酸反应生成n(H2)=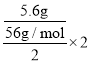 =0.1mol,生成氢气在标况下体积=0.1mol×22.4L/mol,则杂质中金属平均相对原子质量为56(把金属转化为+2价),镁的相对原子质量为24,铝的相对原子质量为27÷3×2=18,都小于56,所以一定含有Cu。
=0.1mol,生成氢气在标况下体积=0.1mol×22.4L/mol,则杂质中金属平均相对原子质量为56(把金属转化为+2价),镁的相对原子质量为24,铝的相对原子质量为27÷3×2=18,都小于56,所以一定含有Cu。

 名校课堂系列答案
名校课堂系列答案【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21.则下列说法不正确的是
X | Y | ||
W | Z |
A.原子半径大小:![]()
B.W、Z的最高价氧化物的水化物的酸性,Z强于W
C.可用W与X的氧化物反应来制备X
D.Y与氢元素可以形成原子个数比为1:1的化合物