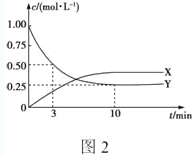
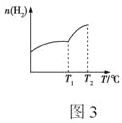
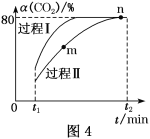
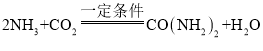题目内容
【题目】甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
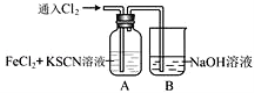
(1)A中铁元素发生反应的离子方程式有______________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在______(填化学符号)。
(3)资料显示:SCN--的电子式为 ![]() 。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是___________(填名称)。
。甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究:取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是___________(填名称)。
【答案】Cl2+2Fe2+═2Cl-+2Fe3+;Fe3++3SCN-=Fe(SCN)3 Fe3+ 硫
【解析】
(1)Fe2+具有还原性,Cl2具有氧化性,发生2Fe2++Cl2=2Fe3++2Cl-,Fe3+与SCN-发生络合反应:Fe3++3SCN-=Fe(SCN)3;
答案为Cl2+2Fe2+═2Cl-+2Fe3+;Fe3++3SCN-=Fe(SCN)3;
(2)黄色溶液中加入NaOH溶液,有红褐色沉淀,该沉淀为Fe(OH)3,说明黄色溶液中含有Fe3+;
答案为Fe3+;
(3)取反应后的溶液,加入盐酸酸化的BaCl2溶液,出现白色沉淀,该沉淀为BaSO4,推出溶液中含有SO42-,而SCN-中S显-2价,说明被氧化的元素是硫元素;
答案为硫。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C原子第一至第四电离能如下: I1=738 kJ·mol-1,I2=1451 kJ·mol-1,I3=7733 kJ·mol-1,I4=10540 kJ·mol-1 |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
![]() ,该同学所画的电子排布图违背了____________。
,该同学所画的电子排布图违背了____________。
(4)G位于第_____族_____区,该元素的核外电子排布式为_____________________________。
(5)检验F元素的方法是____________。
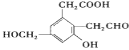
【题目】写出下列有机物的系统命名或结构简式:

(1)_____________
(2)_____________
(3)4,4,5-三甲基-2-己炔 _______________
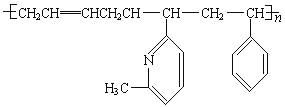
(4)新型弹性材料“丁苯吡橡胶”的结构简式如下:其单体为______________(有几种写几种)
(5)如下表所示,为提纯下列物质(括号内为少量杂质),填写所选用的除杂试剂与主要分离方法
不纯物质 | 除杂试剂 | 分离方法 | |
1 | 溴苯(Br2) | __________ | __________ |
2 | 乙醛(乙酸) | __________ | __________ |
3 | 乙酸乙酯(乙酸) | __________ | __________ |
4 | 乙醇(苯酚) | __________ | __________ |
5 | 硝基苯(硝酸) | __________ | __________ |
(6)①C5H12O的醇,在一定条件下能发生催化氧化反应,产物能与新制的氢氧化铜反应生成红色沉淀,醇的核磁共振氢谱中有三组峰,写出满足上述条件的醇的结构简式______
②C5H12O的醇,在一定条件下不能发生消去反应,写出满足条件的醇的结构简式______
③分子式为C5H12O,不能与金属钠反应.核磁共振氢谱中有四组峰,峰的面积比为3:2:1:6,写出满足上述条件的物质的结构简式______.
【题目】海水中有丰富的资源,多种多样的海洋动物、植物、矿藏等。如图是从海水中提取某些物质的示意图。已知:海水中含量最高的几种离子的浓度依次为
微粒种类 | Cl- | Na+ | Mg2+ |
| Ca2+ |
微粒浓度 | 0.55mol·L-1 | 0.47mol·L-1 | 0.054mol·L-1 | 0.027mol·L-1 | 0.01mol·L-1 |

请根据以上信息回答下列问题:
(1)写出步骤②的操作名称_______;实验室中步骤⑤所需的玻璃仪器除烧杯外,还需要的仪器是___________。
(2)D具有杀菌消毒的作用,请写出反应④的离子方程式___________。
(3)初步提纯后的粗盐中含有等Ca2+、Mg2+、![]() 等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
等杂质,精制得到精盐的步骤顺序为________。(用字母序号填空)
a.加适量盐酸;b.加稍过量的氯化钡溶液,再加稍过量的NaOH溶液;c.过滤;d.蒸发结晶;e.加稍过量碳酸钠溶液
(4)____________(填“能”或“不能”)用![]() 一种试剂替代步骤②中两种试剂,理由是________。
一种试剂替代步骤②中两种试剂,理由是________。