题目内容
9.下表列出了A~R九种元素在周期表的位置:| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+;.(用离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X元素符号是Al,在元素周期表中的位置是(周期、族)第3周期第ⅢA族.
分析 由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、H为Si、R为氮、F为氧、I为硫、G为Cl.
(1)R单质分子为N2,分子中氮原子之间形成3对共用电子对;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)钠与水反应生成氢氧化钠与氢气;
(5)X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应,则X为Al.
解答 解:由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、H为Si、R为氮、F为氧、I为硫、G为Cl.
(1)R单质分子为N2,分子中氮原子之间形成3对共用电子对,电子式为: ,故答案为:
,故答案为: ;
;
(2)同周期自左而右金属性减弱,故金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:K+>Na+>Mg2+,故答案为:K+>Na+>Mg2+;
(4)钠与水反应生成氢氧化钠与氢气,化学反应方程为:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
(5)X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应,则X为Al,位于周期表中,故答案为:Al;第3周期第ⅢA族.
点评 本题考查元素周期表与元素周期律,比较基础,注意整体把握元素周期表的结构,掌握微粒半径比较规律.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
20.用酸性氢氧燃料电池电解饱和食盐水的装置如图所示 (a、b为石墨电极).下列说法中,正确的是( )


| A. | 电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- | |
| B. | 电解时,a 电极周围首先放电的是Cl- | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.2g H2时,b极周围会产生2.24LH2 |
17.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| D. | 标准状况下,22.4 L的CCl4中C-Cl键数为4NA |
4.某元素X的氢化物的化学式为H2X,则X的最高氧化物的水化物的化学式为( )
| A. | H2XO3 | B. | HXO3 | C. | H3XO4 | D. | H2XO4 |
14.吸热反应一定是( )
| A. | 释放能量 | B. | 反应物总能量高于生成物总能量 | ||
| C. | 需要加热 | D. | 反应物总能量低于生成物总能量 |
1.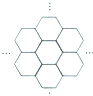 据报道,科学家己经研制出世界上最薄的材料一碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
 据报道,科学家己经研制出世界上最薄的材料一碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )| A. | 碳膜片属于单质 | |
| B. | 碳膜片与C60是同一种物质 | |
| C. | 碳膜片属于人工合成的有机高分子材料 | |
| D. | 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 |
18.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在非金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 在地球上元素的分布和它们在元素周期表中的位置有密切关系 |
19.下列分子中,属于非极性分子的是( )
| A. | SO2 | B. | H2S | C. | BBr3 | D. | COCl2 |
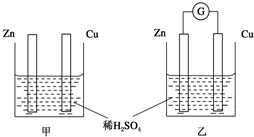 分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题: