题目内容
4.某元素X的氢化物的化学式为H2X,则X的最高氧化物的水化物的化学式为( )| A. | H2XO3 | B. | HXO3 | C. | H3XO4 | D. | H2XO4 |
分析 X的气态氢化物的化学式为H2X,X最低负价为-2,所以最高正价为+6价,为氧族元素,据此解答.
解答 解:X的气态氢化物的化学式为H2X,X最低负价为-2,所以最高正价为+6价,为氧族元素,其最高氧化物的水化物的化学式H2XO4,故选:D.
点评 本题考查原子结构与元素性质,明确元素的最低价和最高价关系是解答本题的关键,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
14.下列各个装置中能组成原电池的是( )
| A. | 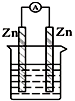 稀硫酸 | B. | 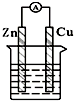 CuSO4溶液 | ||
| C. | 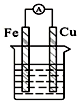 酒精溶液 | D. | 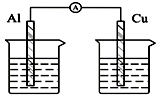 稀硫酸 稀硫酸 |
15.下列物质中,既含有离子键,又含有共价键的是( )
| A. | Na2O | B. | MgCl2 | C. | NaCl | D. | NaOH |
12.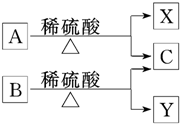 有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
 有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )| A. | X、Y互为同系物 | B. | C分子中的碳原子最多有3个 | ||
| C. | X、Y化学性质不可能相似 | D. | X、Y一定互为同分异构体 |
9.下表列出了A~R九种元素在周期表的位置:
(1)写出R单质分子的电子式 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+;.(用离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X元素符号是Al,在元素周期表中的位置是(周期、族)第3周期第ⅢA族.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+;.(用离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X元素符号是Al,在元素周期表中的位置是(周期、族)第3周期第ⅢA族.
16.在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内气体质量不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内混合气体的密度不随时间变化 | |
| D. | 单位时间内消耗0.1 mol X的同时生成0.2 mol Z |
13.设阿伏伽德罗常数为NA,则下列说法正确的是( )
| A. | 常温下,2.7g铝与足量的氢氧化钠溶液反应失去的电子数为0.1NA | |
| B. | 100mL1mol/LNa2SO4溶液中含Na+个数为0.1NA | |
| C. | 1.7gNH3中含电子数为NA | |
| D. | 11.2gCO2与8.5gNH3所含分子数都是0.5NA |
14.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)⑦是什么元素Al(用元素符号表示).
(2)请写出⑨的原子结构示意图 .
.
(3)②、③、④、⑤的半径从大到小的顺序是C>N>O>F(用元素符号表示).
(4)⑥与⑦两种元素金属性强弱顺序为:⑥>⑦(填“>”或“<”或“=”)
(5)①与③形成的最简单化合物的电子式: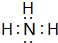
(6)请写出⑧元素最高价氧化物的化学式:SO3.⑥的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物相互反应的化学方程式:Al(OH)3+NaOH=NaAlO2+2H2O.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)请写出⑨的原子结构示意图
 .
.(3)②、③、④、⑤的半径从大到小的顺序是C>N>O>F(用元素符号表示).
(4)⑥与⑦两种元素金属性强弱顺序为:⑥>⑦(填“>”或“<”或“=”)
(5)①与③形成的最简单化合物的电子式:
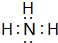
(6)请写出⑧元素最高价氧化物的化学式:SO3.⑥的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物相互反应的化学方程式:Al(OH)3+NaOH=NaAlO2+2H2O.
 .
.