题目内容
17.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| D. | 标准状况下,22.4 L的CCl4中C-Cl键数为4NA |
分析 A、1L0.1mol/L的NH4NO3溶液中含有溶质硝酸铵0.1mol,0.1mol硝酸铵中含有0.2mol氮原子;
B、合成氨的反应为可逆反应;
C、I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,转移5e-;
D、标况下,四氯化碳为液态.
解答 解:A、1L0.1mol/L的NH4NO3溶液中含有溶质硝酸铵的物质的量为0.1mol,0.1mol硝酸铵中含有0.2mol氮原子,含有的氮原子数为0.2NA,故A正确;
B、合成氨的反应为可逆反应,不能进行彻底,故得到NH3分子数小于NA,故B错误;
C、在反应KIO3+6HI=KI+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,生成3mo1I2转移的电子数为5NA,故C错误;
D、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
8.下列物质一定属于同系物的是( )
①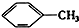 ②
② ③
③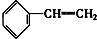 ④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
①
 ②
② ③
③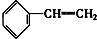 ④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
| A. | ④和⑧ | B. | ①②和③ | C. | ⑦和⑧ | D. | ④⑥和⑧ |
5.下列有关金属的说法正确的是( )
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 镁型和铜型的原子堆积方式空间利用率最高 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 温度升高,金属的导电性将变大 |
12.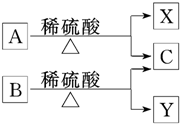 有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
 有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )| A. | X、Y互为同系物 | B. | C分子中的碳原子最多有3个 | ||
| C. | X、Y化学性质不可能相似 | D. | X、Y一定互为同分异构体 |
2.铝用来焊接钢轨是利用( )
| A. | 铝同氧气反应生成稳定的保护层 | B. | 铝是热的良导体 | ||
| C. | 铝是强还原剂,铝热反应放热 | D. | 铝合金强度大 |
9.下表列出了A~R九种元素在周期表的位置:
(1)写出R单质分子的电子式 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+;.(用离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X元素符号是Al,在元素周期表中的位置是(周期、族)第3周期第ⅢA族.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+;.(用离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X元素符号是Al,在元素周期表中的位置是(周期、族)第3周期第ⅢA族.
6.下列反应的离子方程式书写正确的是( )
| A. | 碳酸钙和醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氢氧化镁与硫酸溶液反应 H++OH-=H2O | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al (OH)3↓+3NH4+ | |
| D. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
7.某金属A不溶于冷的浓硝酸,A与银用导线连接后浸入硫酸溶液,所组成的原电池中电流由银极通过导线流回A极,则A可能是( )
| A. | Pt | B. | Cu | C. | Zn | D. | Al |
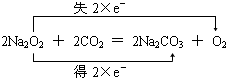 .
.