题目内容
19.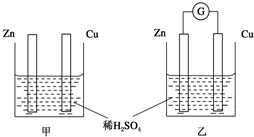 分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:(1)以下叙述中,正确的是C、D.
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:乙为化学能转化为电能.
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是锌片不纯,在锌片上形成原电池.
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:Cu2++2e-=Cu.
分析 锌比铜活泼,能与稀硫酸反应,铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲没有形成闭合回路,不能形成原电池,乙形成闭合回路,形成原电池,根据原电池的组成条件和工作原理解答该题.
解答 解:(1)A.没有形成闭合回路,不能形成原电池,故A错误;
B.铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲烧杯中铜片表面没有气泡产生,故B错误;
C.两烧杯中硫酸都参加反应,氢离子浓度减小,溶液的pH均增大,故C正确;
D.乙能形成原电池反应,较一般化学反应速率更大,所以产生气泡的速率甲中比乙中慢,故D正确;
E.原电池电子由负极经外电路流向正极,乙形成原电池,Zn为负极,Cu为正极,则电流方向Cu→Zn,故E错误.
故答案为:C、D;
(2)乙形成闭合回路,形成原电池,将化学能转变为电能;故答案为:化学能转化为电能;
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,是由于锌片不纯,在锌片上形成原电池导致,
故答案为:锌片不纯,在锌片上形成原电池;
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,Cu2+在正极上得电子被还原产生Cu,电极反应式为Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu.
点评 本题考查原电池的组成和工作原理,题目难度不大,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.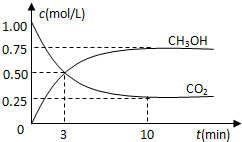 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的密闭容器中(体积不变)充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 进行到3分钟时,正反应速率和逆反应速率相等 | |
| B. | 10分钟后容器中各物质浓度不再改变 | |
| C. | 达到平衡后,升高温度,正反应速率增大、逆反应速率减小 | |
| D. | 3min前v正>v逆,3min后v正<v逆 |
10.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为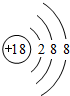 .
.
(2)地壳中含量最多的金属元素是Al;写出②与④按1:1形成的化合物的电子式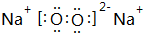 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(4)写出③、⑦、⑧对应的简单阴离子的还原性由强到弱的次序S2->Cl->F-
(5)④的最高价氧化物的水化物和⑤的最高价氧化物相互反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O
(6)⑤和⑧组成的化合物中有共价键(化学键类型).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 四 | ⑩ |
 .
.(2)地壳中含量最多的金属元素是Al;写出②与④按1:1形成的化合物的电子式
 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(4)写出③、⑦、⑧对应的简单阴离子的还原性由强到弱的次序S2->Cl->F-
(5)④的最高价氧化物的水化物和⑤的最高价氧化物相互反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O
(6)⑤和⑧组成的化合物中有共价键(化学键类型).
14.下列各个装置中能组成原电池的是( )
| A. | 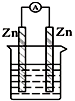 稀硫酸 | B. | 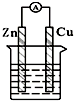 CuSO4溶液 | ||
| C. | 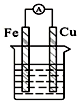 酒精溶液 | D. | 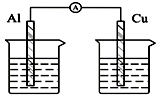 稀硫酸 稀硫酸 |
4.下列说法正确的是( )
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙 | |
| B. | 对苯二甲酸(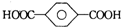 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (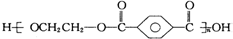 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. | 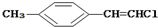 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
8.下列物质一定属于同系物的是( )
①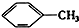 ②
② ③
③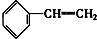 ④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
①
 ②
② ③
③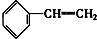 ④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
| A. | ④和⑧ | B. | ①②和③ | C. | ⑦和⑧ | D. | ④⑥和⑧ |
9.下表列出了A~R九种元素在周期表的位置:
(1)写出R单质分子的电子式 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+;.(用离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X元素符号是Al,在元素周期表中的位置是(周期、族)第3周期第ⅢA族.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+;.(用离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X元素符号是Al,在元素周期表中的位置是(周期、族)第3周期第ⅢA族.
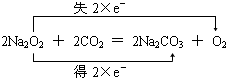 .
.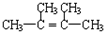 ;
;
 ;
;