题目内容
20.用酸性氢氧燃料电池电解饱和食盐水的装置如图所示 (a、b为石墨电极).下列说法中,正确的是( )
| A. | 电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- | |
| B. | 电解时,a 电极周围首先放电的是Cl- | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.2g H2时,b极周围会产生2.24LH2 |
分析 左边能自发的进行氧化还原反应,为原电池,氢气失电子发生氧化反应,则通入氢气的电极是负极,通入氧气的电极是正极,正极上氧气得电子发生还原反应;
右边是电解池,a是阳极,b是阴极,阳极上氯离子放电,阴极上氢离子放电,电子从负极流向阴极,从阳极流向正极.
解答 解:A.酸性介质中,氢氧燃料电池中阳极上氧气得电子发生还原反应,电极反应式为O2+4H++4e-═2H2O,故A错误;
B.还原性强的离子在阳极先放电,电解时,a电极周围首先放电的是Cl-,故B正确;
C.电解时,电子流动路径是:负极→外电路→阴极,阳极→外电路→正极,电子不能通过溶液,故C错误;
D.根据转移电子相等知,当电池中消耗0.2g H2时,b极周围会产生0.2g H2,即$\frac{0.2g}{2g/mol}$=0.1mol,但未指明标况,不能确定体积为2.24LH2,故D错误;
故选:B.
点评 本题考查了原电池和电解池,明确原电池和电解池原理是解本题关键,知道离子的放电顺序,易错选项是C,注意电子不进入电解质溶液,溶液中阴阳离子定向移动而形成电流,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为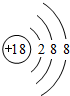 .
.
(2)地壳中含量最多的金属元素是Al;写出②与④按1:1形成的化合物的电子式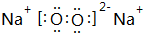 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(4)写出③、⑦、⑧对应的简单阴离子的还原性由强到弱的次序S2->Cl->F-
(5)④的最高价氧化物的水化物和⑤的最高价氧化物相互反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O
(6)⑤和⑧组成的化合物中有共价键(化学键类型).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 四 | ⑩ |
 .
.(2)地壳中含量最多的金属元素是Al;写出②与④按1:1形成的化合物的电子式
 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(4)写出③、⑦、⑧对应的简单阴离子的还原性由强到弱的次序S2->Cl->F-
(5)④的最高价氧化物的水化物和⑤的最高价氧化物相互反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O
(6)⑤和⑧组成的化合物中有共价键(化学键类型).
8.下列物质一定属于同系物的是( )
①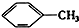 ②
② ③
③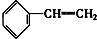 ④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
①
 ②
② ③
③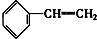 ④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6 ⑦ ⑧
⑧
| A. | ④和⑧ | B. | ①②和③ | C. | ⑦和⑧ | D. | ④⑥和⑧ |
15.下列物质中,既含有离子键,又含有共价键的是( )
| A. | Na2O | B. | MgCl2 | C. | NaCl | D. | NaOH |
5.下列有关金属的说法正确的是( )
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 镁型和铜型的原子堆积方式空间利用率最高 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 温度升高,金属的导电性将变大 |
12.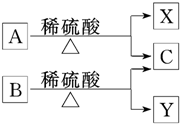 有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
 有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )
有机物A与B是分子式为C5H10O2的同分异构体,在酸性条件下均可水解,水解产物如图所示,下列有关说法中正确的是( )| A. | X、Y互为同系物 | B. | C分子中的碳原子最多有3个 | ||
| C. | X、Y化学性质不可能相似 | D. | X、Y一定互为同分异构体 |
9.下表列出了A~R九种元素在周期表的位置:
(1)写出R单质分子的电子式 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+;.(用离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X元素符号是Al,在元素周期表中的位置是(周期、族)第3周期第ⅢA族.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+;.(用离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X元素符号是Al,在元素周期表中的位置是(周期、族)第3周期第ⅢA族.
 ;
;
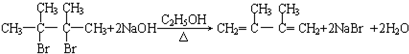 ;
;