题目内容
18.RO3n-中共有x个电子,R原子的质量数为A,则a克RO3n-中含有质子的物质的量为( )| A. | $\frac{a}{A+48}$(x-n)mol | B. | $\frac{a}{A+48}$(x-24-n)mol | C. | $\frac{a}{A+48}$(x+n)mol | D. | (x-n)mol |
分析 阴离子核外电子数=质子数之和+所得电荷数,据此计算R元素原子的质子数,进而计算RO3n-中质子总数目,根据n=$\frac{m}{M}$计算a克RO3n-的总的物质的量,据此计算,注意R原子的质量数近似为其相对原子质量.
解答 解:RO3n-中共有x个电子,则R原子质子数为x-n-8×3=x-n-24,
R原子的质量数为A,则a克RO3n-的物质的量为$\frac{ag}{(A+48)g/mol}$=$\frac{a}{A+48}$mol,
故a克RO3n-中含质子的物质的量为$\frac{a}{A+48}$mol×(x-n-24)=$\frac{a}{A+48}$(x-24-n)mol,
故选B.
点评 本题考查物质的量有关计算,明确物质的量公式及中子数、电子数和质量数之间关系是解本题关键,熟练掌握物质的量有关公式,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
9.下列说法正确的是( )
| A. | 1mol乙烯与Cl2完全加成,然后再与Cl2完全取代,共需5mol Cl2 | |
| B. | 乙烯、苯都能使溴水褪色,两者的褪色原理相同 | |
| C. | 2-丁烯不存在顺反异构体 | |
| D. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是法国化学家李比希 |
3.某无色溶液含有相同浓度的下列离子中的4种离子:K+、Na+、Al3+、Fe3+、Mg2+、Cl-、CO${\;}_{3}^{2-}$、
SO42-( )
①取少量溶液于试管中,滴加 BaCl2溶液,有白色沉淀产生,往沉淀中加盐酸,无明显现象
②用干净的铂丝蘸取少量原溶液进行焰色反应,发现火焰颜色为黄色.
SO42-( )
①取少量溶液于试管中,滴加 BaCl2溶液,有白色沉淀产生,往沉淀中加盐酸,无明显现象
②用干净的铂丝蘸取少量原溶液进行焰色反应,发现火焰颜色为黄色.
| A. | 有现象②可知有 Na+,没有 K+ | |
| B. | 不能确定溶液中有无 Al3+ | |
| C. | 溶液中一定存在 SO${\;}_{4}^{2-}$、Na+、K+ | |
| D. | 溶液中如果存在Cl-则肯定存在 Mg2+ |
10.用铁与稀硫酸反应制取氢气时,下列不能使氢气生成速率加大的是( )
| A. | 在稀硫酸溶液中滴加少量硫酸铜溶液 | |
| B. | 不用稀硫酸,改用98%的浓硫酸 | |
| C. | 不用1 mol/L稀硫酸,改用2 mol/L硫酸 | |
| D. | 不用铁片,改用铁粉 |
7.下列离子方程式正确的是( )
| A. | MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ | |
| B. | FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ | |
| C. | 酸性高锰酸钾溶液中滴加双氧水:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | 偏铝酸钠溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- |
8.有BaCl2和NaCl的混合溶液V L,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液使Cl-离子完全沉淀.反应中消耗H2SO4x mol、AgNO3y mol,据此得知原混合溶液中的Na+浓度c(Na+)/mol•L-1为( )
| A. | $\frac{y-2x}{V}$ | B. | $\frac{2y-4x}{V}$ | C. | $\frac{2y-2x}{V}$ | D. | $\frac{y-x}{V}$ |
 .
.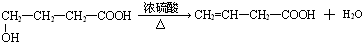 ;反应类型是:消去反应.利用C可以合成高分子化合物D,D的结构简式是:
;反应类型是:消去反应.利用C可以合成高分子化合物D,D的结构简式是: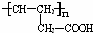 ;
; .
. 如图所示,a、b均为活塞,可控制气体的通过和液体的加入,实验前活塞均已关闭(仪器的固定装置已省略).请选择最适宜的试剂,利用下图,把一定量的CO2和CO混合气体中的CO2和CO分离.
如图所示,a、b均为活塞,可控制气体的通过和液体的加入,实验前活塞均已关闭(仪器的固定装置已省略).请选择最适宜的试剂,利用下图,把一定量的CO2和CO混合气体中的CO2和CO分离.