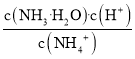题目内容
【题目】进行一氯取代后,只能生成四种沸点不同的有机物,则该烷烃是( )
A.(CH3)2CHCH2CH2CH3B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2D.(CH3)3CCH3
【答案】B
【解析】
进行一氯取代后,只能生成四种沸点不同的有机物,即该物质中有4种环境的氢原子,一氯代物有4种;
A.(CH3)2CHCH2CH2CH3即为:![]() ,分子中含有5种位置不同的H原子,所以其一氯代物有5种,故A不符合题意;
,分子中含有5种位置不同的H原子,所以其一氯代物有5种,故A不符合题意;
B.(CH3CH2)2CHCH3即为: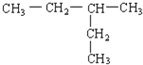 ,分子中含有4种位置不同的H原子,故其一氯代物有4种,故B符合题意;
,分子中含有4种位置不同的H原子,故其一氯代物有4种,故B符合题意;
C.(CH3)2CHCH(CH3)2即为:![]() ,分子中含有2种化学环境不同的H原子,所以其一氯代物有2种,故C不符合题意;
,分子中含有2种化学环境不同的H原子,所以其一氯代物有2种,故C不符合题意;
D.(CH3)3CCH3即为 ,分子中含有1种化学环境不同的H原子,其一氯代物有1种,故D不符合题意;
,分子中含有1种化学环境不同的H原子,其一氯代物有1种,故D不符合题意;
故选:B。

【题目】某小组研究第3周期元素性质的递变规律,设计了如下实验,并记录了实验现象:
实验步骤 | 实验现象 |
①将一小块钠放入滴有酚酞的冷水中 | A.有气体产生,溶液变成浅红色 |
②将用砂纸打磨过的镁条放入沸水中,再向其中滴加少量酚酞溶液 | B.浮在水面上,熔成小球,做不定向运动,随后消失,溶液变为红色 |
③将镁条放入稀盐酸中 | C.反应较快,产生无色气体 |
④将铝条放入稀盐酸中 | D.反应剧烈,迅速产生大量无色气体 |
(1)补齐实验步骤与实验现象之间的连线___________。

(2)由上述实验可知Na、Mg、Al三种元素原子失电子能力(金属性)依次_______(填“增强”或“减弱”)。从原子结构的角度解释原因____________。
(3)比较第3周期中硫与氯两种元素原子得电子能力(非金属性)的相对强弱。
①甲同学设计的下列方法可行的是_______。
A.比较气态氢化物的稳定性 B.比较盐酸与硫酸的酸性 C.比较单质与酸反应置换出氢气的难易程度
②乙同学设计将氯气通入硫化钠溶液中,观察是否有淡黄色沉淀生成。这一实验的设计思路是通过比较________,推知元素原子得电子能力的相对强弱。
(4)利用元素周期律可预测陌生元素及物质的性质,已知Rb与Na处于同一主族,下列说法正确的是_____。
A.失电子能力:Rb>Na B.碱性:NaOH>RbOH C.Rb比Na更容易与氧气发生反应 D.Rb不易与水反应放出H2
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L