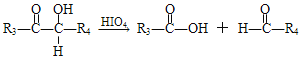题目内容
【题目】在如图所示实验装置,X为直流电源的负极。甲池中充满H2SO4溶液,再分别插入铂电极。乙池中盛有AgNO3溶液,F、G为石墨电极。
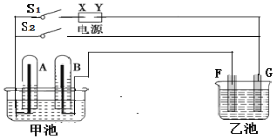
切断开关S2,闭合开关S1,通直流电一段时间
①甲池总反应方程式:____________;
②F电极反应方程式:___________;
③G电极的现象:______________;
④若F电极增重10.8g,B极上放出气体的体积(STP)是_______L;
⑤切断电源开关S1,闭合开关S2,此时甲池为__________(填原电池、电解池),A电极反应方程式:______。
【答案】2H2O![]() 2H2↑+O2↑ Ag++e-=Ag 有气体产生 0.56 原电池 H2-2e-=2H+
2H2↑+O2↑ Ag++e-=Ag 有气体产生 0.56 原电池 H2-2e-=2H+
【解析】
切断开关S2,闭合开关S1,通直流电时,该装置为电解池,X为直流电源的负极,则A为阴极,发生还原反应4H++4e-=2H2↑,B为阳极,且OH-比SO42-更容易失去电子被氧化4OH--4e-=O2↑+2H2O,乙池中,F为阴极发生还原反应Ag++e-=Ag,G为阳极发生氧化反应4OH--4e-=O2↑+2H2O。
切断电源开关S1,闭合开关S2时,甲池中为原电池装置,A极为负极,发生氧化反应:H2-2e-=2H+,B为正极,发生还原反应:O2+4e-+4H+=2H2O。根据此分析进行解答。
(1)切断电源开关S2,闭合开关S1时,甲池为电解池,X为直流电源的负极,则A为阴极,发生还原反应4H++4e-===2H2↑,B为阳极,且OH-比SO42-更容易失去电子被氧化4OH--4e-=O2↑+2H2O,故甲池总反应方程式为2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。
故答案为2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(2)乙池中,F为阴极,银离子得电子发生还原反应Ag++e-=Ag。
故答案为Ag++e-=Ag;
(3)G为阳极,氢氧根发生氧化反应生成氧气和水4OH--4e-===O2↑+2H2O,故G电极上会有气体放出。
故答案为有气体产生;
(4)F为阴极,银离子得电子发生还原反应Ag++e-=Ag,F电极增重10.8g为银的质量,转换为银的物质的量为0.1mol,故反应转移电子0.1mol,B为阳极发生氧化反应4OH--4e-===O2↑+2H2O,故产生氧气0.025mol,体积为0.025mol×22.4L/mol=0.56L。
故答案为0.56L;
(5)若切断电源开关S1,闭合开关S2时,甲池中变换为原电池装置,A极为负极,氢气发生氧化反应:H2-2e-=2H+,B为正极,氧气发生还原反应:O2+4e-+4H+=2H2O。
故答案为H2-2e-=2H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案