题目内容
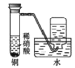
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
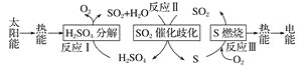
(1)反应Ⅰ:2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)===SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________。
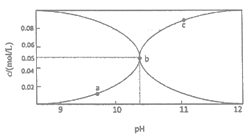
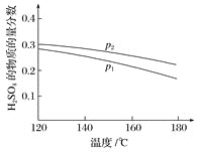
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2___p1(填“>”或“<”),得出该结论的理由是____。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+===S↓+2I2+2H2O
ⅱ.I2+2H2O+_____===_____+____+2I-
(4)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mLSO2饱和溶液加入2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
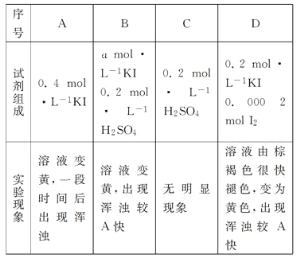
①B是A的对比实验,则a=_____。
②比较A、B、C,可得出的结论是_______。
③实验表明,SO2的歧化反应速率D>A。结合ⅰ、ⅱ反应速率解释原因:________。
【答案】3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH2=-254kJ·mol-1 > 反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,H2SO4的物质的量增大,体系总物质的量减小,H2SO4的物质的量分数增大 SO2 SO42- 4H+ 0.4 I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率 反应ⅱ比ⅰ快;D中由反应ⅱ产生的H+使反应ⅰ加快
【解析】
(1)根据图知,反应II为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),将方程式IIII即得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),△H=(+551kJmol1)(297kJmol1)=254kJ/mol,
故答案为:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),△H=254kJ/mol;
(2)相同温度下,增大压强,平衡正向移动,导致硫酸在平衡体系中物质的量分数增大,根据图知,相同温度下,达到平衡状态时硫酸含量:P1<P2,说明压强P2>P1,
故答案为:>;当温度相同时,增大压强,平衡正向移动,导致硫酸在平衡体系中物质的量分数增大;
(3)化学反应中的催化剂在第一个反应中作反应物、第二个反应中作生成物,总方程式为得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),催化过程中i:SO2+4I+4H+=S↓+2I2+2H2O,说明I、H+在i中作反应物,在ii中作生成物,同时ii中还生成H2SO4,根据元素守恒知,反应物还有SO2,所以ii中方程式应该为:I2+2H2O+SO2═4H++SO42+2I,
答案为:SO2;4H+;SO42;
(4)①B是A的对比实验,所用c(KI)应该相等,否则无法得出正确结论,所以a=0.4,
故答案为:0.4;
②比较A. B.C,A中只含KI、B中含有KI和硫酸、C中只含硫酸,反应快慢顺序是B>A>C,且C中没有明显现象,说明不反应,B中含有酸导致其反应速率加快,所以得出的结论是:在酸性条件下,SO2与I反应速率更快,且SO2与稀硫酸不发生反应,
故答案为:在酸性条件下,SO2与I反应速率更快,且SO2与稀硫酸不发生反应;
③反应i、ii知,SO2先和I反应生成I2,I2再和SO2进一步反应,D中KI溶液溶解了I2,导致D中的ii的反应较A快,所以看到的现象是:D中出现浑浊较A快,
故答案为:反应i、ii知,SO2先和I反应生成I2,I2再和SO2进一步反应,D中KI溶液溶解了I2,导致D中的ii的反应较A快。