题目内容
5.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )| A. | 原子半径A<B<C | B. | A的氢化物的稳定性大于C的氢化物 | ||
| C. | B的氧化物熔点比A的氧化物高 | D. | A与C可形成离子化合物 |
分析 A与C同主族,B原子最外层电子数等于A原子次外层电子数,主族元素最外层电子数不超过8,故A元素原子只能有2个电子层,A处于第二周期,B原子最外层电子数为2,故B处于ⅡA族.它们的原子的最外层电子数之和为10,可知A、C的最外层电子数为4,故A为C元素、C为Si元素,A、B、C原子序数依次递增,则B为Mg元素,据此解答.
解答 解:A与C同主族,B原子最外层电子数等于A原子次外层电子数,主族元素最外层电子数不超过8,故A元素原子只能有2个电子层,A处于第二周期,B原子最外层电子数为2,故B处于ⅡA族.它们的原子的最外层电子数之和为10,可知A、C的最外层电子数为4,故A为C元素、C为Si元素,A、B、C原子序数依次递增,则B为Mg元素.
A.A为C元素,B为Mg元素,C为Si元素,同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,所以原子半径为C<Si<Mg,故A错误;
B.同主族自上而下非金属性减弱,非金属性越强,氢化物的越强,非金属性C>Si,故氢化物的稳定性CH4>SiH4,故B正确;
C.A的氧化物为分子晶体,B的氧化物为离子晶体,B的氧化物的熔点比A的氧化物高,故C正确;
D.A与C形成的化合物为SiC,为共价化合物,故D错误.
故选:BC.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,本题注意晶体类型的区别.

练习册系列答案
相关题目
15.下列判断中,正确的是( )
| A. | AlCl3溶液和Al2(SO4)3溶液加热蒸干,灼烧都得到Al2O3 | |
| B. | 25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Ksp大小顺序为:盐酸>氯化铵>蒸馏水 | |
| C. | 已知25℃时,NH4F溶液显酸性,则电离常数K(NH3•H2O)<K(HF) | |
| D. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合溶液中,c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
16.某人设想利用①3FeCl2+4H2OFe3O4+6HCl+H2②Fe3O4+Cl2+6HCl3FeCl3+3H2O+O2 ③3FeCl33FeCl2+Cl2 这三个反应的联合与循环,主要用来生产能解决环境和能源问题的某种气体,该气体是( )
| A. | O2 | B. | Cl2 | C. | HCl | D. | H2 |
13.下列说法正确的是( )
| A. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
20.能够直接鉴别BaCl2、NaCl、Na2CO3三种溶液的试剂是( )
| A. | AgNO3溶液 | B. | 稀硫酸 | C. | 稀盐酸 | D. | 稀硝酸 |
10.下列化合物分别跟溴在铁粉作催化剂的条件下反应,苯环上的氢原子被取代,所得一溴代物有三种同分异构体的是( )
①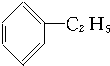 ②
②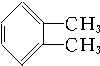 ③
③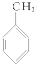 ④
④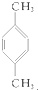
①
 ②
② ③
③ ④
④
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
17.下面是有关弱酸的电离平衡常数.结合数据,分析下列有关说法,其中错误的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1 mol•L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | 升高温度,HCN溶液中H+浓度增大,平衡正向移动,电离平衡常数增大 | |
| C. | 向稀醋酸中逐滴加水,或加入少量冰醋酸,CH3COOH的电离平衡都正向移动 | |
| D. | 向CH3COOH溶液中加入少量氢氧化钠固体,平衡正向移动 |
15.欲用96%的乙醇溶液制取无水乙醇时,可选用的方法是( )
| A. | 加入无水CuSO4,再过滤 | |
| B. | 加入生石灰,再蒸馏 | |
| C. | 加入浓H2SO4,再加热,蒸出乙醇 | |
| D. | 将96%的乙醇溶液直接加热蒸馏出来 |