题目内容
16.某人设想利用①3FeCl2+4H2O$\stackrel{500℃}{→}$Fe3O4+6HCl+H2②Fe3O4+$\frac{3}{2}$Cl2+6HCl$\stackrel{100℃}{→}$3FeCl3+3H2O+$\frac{1}{2}$O2 ③3FeCl3$\stackrel{300℃}{→}$3FeCl2+$\frac{3}{2}$Cl2 这三个反应的联合与循环,主要用来生产能解决环境和能源问题的某种气体,该气体是( )| A. | O2 | B. | Cl2 | C. | HCl | D. | H2 |
分析 由①3FeCl2+4H2O$\stackrel{500℃}{→}$Fe3O4+6HCl+H2、②Fe3O4+$\frac{3}{2}$Cl2+6HCl$\stackrel{100℃}{→}$3FeCl3+3H2O+$\frac{1}{2}$O2、③3FeCl3$\stackrel{300℃}{→}$3FeCl2+$\frac{3}{2}$Cl2 这三个反应的联合与循环可知,①+②+③得到H2O$\stackrel{△}{→}$$\frac{1}{2}$O2+H2,以此来解答.
解答 解:由①3FeCl2+4H2O$\stackrel{500℃}{→}$Fe3O4+6HCl+H2、②Fe3O4+$\frac{3}{2}$Cl2+6HCl$\stackrel{100℃}{→}$3FeCl3+3H2O+$\frac{1}{2}$O2、③3FeCl3$\stackrel{300℃}{→}$3FeCl2+$\frac{3}{2}$Cl2 这三个反应的联合与循环可知,①+②+③得到H2O$\stackrel{△}{→}$$\frac{1}{2}$O2+H2,氧气具有助燃性,而氢气具有可燃性,则主要用来生产能解决环境和能源问题的某种气体为H2,
故选D.
点评 本题以信息的形式考查盖斯定律的应用,为高频考点,把握已知反应及总反应、气体的性质为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.已知酸性: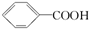 >H2CO3>
>H2CO3>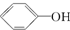 ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将 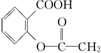 转变为
转变为 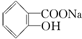 的最佳方法是( )
的最佳方法是( )
 >H2CO3>
>H2CO3> ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将  转变为
转变为  的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与足量的NaOH溶液共热后,再加入适量H2SO4 |
7.下列各物质的化学式、对应的名称(或俗名)、物质所属的类别都正确的是( )
| A. | Na2O2 过氧化钠 碱性氧化物 | B. | CO2二氧化碳 酸性氧化物 | ||
| C. | H2SO3硫酸 酸 | D. | Na2CO3 纯碱 碱 |
4.下列叙述中,错误的是( )
| A. | 同温同压下,气体的体积之比等于它们的物质的量之比 | |
| B. | 同温同压下,气体的体积之比等于它们的质量之比 | |
| C. | 同温同压下,相同体积的气体的质量之比等于它们的相对分子质量之比 | |
| D. | 同温同压下,气体的密度之比等于它们的相对分子质量之比 |
11.某温度下,NaOH的溶解度为ag,该温度下,用bg水溶解一定量的Na2O2形成饱和溶液,需加入的Na2O2的质量为( )
| A. | $\frac{39ab}{4000-9a}$g | B. | $\frac{ab}{100}$g | C. | $\frac{39ab}{4000}$g | D. | $\frac{39ab}{4000+9a}$g |
5.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )
| A. | 原子半径A<B<C | B. | A的氢化物的稳定性大于C的氢化物 | ||
| C. | B的氧化物熔点比A的氧化物高 | D. | A与C可形成离子化合物 |
