题目内容
3.用CH4催化还原NOx可以消除氮氧化物的污染.例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1;平衡常数为K1;
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g)△H=+1160kJ•mol-1;平衡常数为K2.
请回答下列问题:
(1)反应CH4+2NO2=N2+CO2+2H2O(g) 的平衡常数K=√K1•K2(用K1、K2表示).
(2)若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为9.6×1023或1.6NA(阿伏伽德罗常数用NA表示),放出的热量为173.4kJ.
分析 (1)依据已知的热化学方程式利用盖斯定律解答;
(2)已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1,利用盖斯定律将①+②2可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-574+11602kJ•mol-1=867kJ•mol-1,以此解答该题;
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由盖斯定律①+②2可得得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-574+11602kJ•mol-1=867kJ•mol-1,则K=√K1•K2,故答案为:√K1•K2;
(2)由(1)得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-574+11602kJ•mol-1=867kJ•mol-1,n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol×8NA=1.6NA=9.6×1023,放出的热量为0.2×867=173.4kJ,
故答案为:9.6×1023或1.6NA;173.4.
点评 本题考查反应热以及氧化还原反应的计算,侧重于学生的计算能力和分析能力的考查,注意盖斯定律的应用,题目难度不大.

练习册系列答案
相关题目
11.实验室里钠保存在下列哪种液体中( )
| A. | 煤油 | B. | 水 | C. | 汽油 | D. | 四氯化碳 |
14.SF6是一种优良的绝缘气体,分子结构中只存在S-F键.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F-F、S-F键需吸收的能量分别为160kJ、330kJ.则反应S(s)+3F2(g)═SF6(g)的能量变化为( )
| A. | 放出1780kJ的能量 | B. | 放出1220kJ的能量 | ||
| C. | 放出450kJ的能量 | D. | 吸收430kJ的能量 |
18.碘钨灯比白炽灯使用寿命长.灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:WI2(g)?W(s)+I2(g)△H>0.下列说法正确的是( )
| A. | 灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W重新沉积到灯丝上 | |
| B. | 灯丝附近温度越高,WI2(g)的转化率越低 | |
| C. | 该反应的平衡常数表达式是K=c(W)•c(I2)c(WI2) | |
| D. | 灯内温度升高时,压强不会变 |
8.下列说法不正确的是( )
| A. | 凡是铵盐均能与苛性钠共热产生氨气 | |
| B. | 向铜粉中加人稀硫酸,铜粉不溶解;再加人Cu(NO3)2固体,铜粉溶解 | |
| C. | 普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 | |
| D. | 将二氧化硫通人溴水,溴水褪色后加热不能恢复原色 |
15.下列说法或鉴定溴乙烷中溴元素存在的最佳操作是( )
| A. | 甲酸与氢氧化钠溶液反应生成NaCOOH | |
| B. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| C. | 加入NaOH溶液,加热后再加入稀硝酸酸化,然后加入AgNO3溶液 | |
| D. | 加入NaOH的乙醇溶液,加热后再加入AgNO3溶液 |
13.下列说法正确的是( )
| A. | H2Se的沸点高于H2S,可推测PH3的沸点高于NH3 | |
| B. | 17g羟基(-OH)所含有的电子数是9NA | |
| C. | σ键是镜面对称,而π键是轴对称 | |
| D. | 标准状况下,11.2 L三氯甲烷所含分子数为0.5 NA |
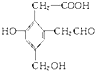 ,取足量的Na、NaOH和新制Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需 Na、NaOH和新制Cu(OH)2三种物质的物质的量之比为3:2:3.
,取足量的Na、NaOH和新制Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需 Na、NaOH和新制Cu(OH)2三种物质的物质的量之比为3:2:3. .
. ;D、E形成的化合物:
;D、E形成的化合物: .
.