题目内容
11.某有机物A的结构简式为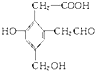 ,取足量的Na、NaOH和新制Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需 Na、NaOH和新制Cu(OH)2三种物质的物质的量之比为3:2:3.
,取足量的Na、NaOH和新制Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需 Na、NaOH和新制Cu(OH)2三种物质的物质的量之比为3:2:3.
分析 由结构可知,酚-OH、-COOH、醇-OH均可与钠反应,酚-OH、-COOH与NaOH反应,-CHO、-COOH与新制氢氧化铜悬浊液(可加热)反应,以此来解答.
解答 解:由结构可知,酚-OH、-COOH、醇-OH均可与钠反应,酚-OH、-COOH与NaOH反应,-CHO、-COOH与新制氢氧化铜悬浊液(可加热)反应,
则1mol该有机物消耗Na为3mol,
1mol该有机物消耗NaOH为2mol,
1mol该有机物消耗新制氢氧化铜悬浊液3mol(1mol-CHO消耗2mol氢氧化铜悬浊液,生成的-COOH和原有的-COOH共消耗1mol氢氧化铜悬浊液),
所以消耗的钠、氢氧化钠、氢氧化铜的物质的量之比3mol:2mol:3mol=3:2:3,
故答案为:3:2:3.
点评 本题考查有机物的结构与性质,注意把握官能团、性质的关系为解答的关键,熟悉苯酚、醇、酸、醛的性质即可解答,与氢氧化铜的反应为解答的难点和易错点,题目难度中等.

练习册系列答案
相关题目
19.碱金属的阳离子( )
| A. | 是强还原剂 | B. | 只有氧化性 | ||
| C. | 易被氧化 | D. | 其火焰都能呈现不同颜色 |
2.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作Ⅰ的名称是过滤,固体X中主要含有Fe2O3、MgO(填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为Al(OH)3(写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+?Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害.电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀.
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3):n(H2)=1:1)
6Fe+1Cr2O72-+2H++17H2O═6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10-32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于5.6.(已知lg2=0.3)

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作Ⅰ的名称是过滤,固体X中主要含有Fe2O3、MgO(填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为Al(OH)3(写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+?Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为Cr2O72-+6Cl-+14H+=2 Cr3++3Cl2↑+7 H2O.
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是:K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3):n(H2)=1:1)
6Fe+1Cr2O72-+2H++17H2O═6Fe(OH)3↓+2Cr(OH)3↓+6H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10-32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于5.6.(已知lg2=0.3)
19.Se是人体必需微量元素,下列有关3478Se和3480Se的说法正确的是( )
| A. | 3478Se和3480Se 分别含有44和46个质子 | |
| B. | 3478Se和3480Se互为同位素 | |
| C. | 3478Se 和3480Se互为同素异形体 | |
| D. | 3478Se和3480Se都含有34个中子 |
6.下列有关化学用语表达正确的是( )
| A. | 乙酸分子的球棍模型: | |
| B. | H2O2的电子式: | |
| C. | 乙醇的分子式:C2H5OH | |
| D. | 离子结构示意图 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
16.在容积可变的密闭容器中,2molN2和8molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的转化率近于( )
| A. | 20% | B. | 25% | C. | 33% | D. | 35% |

 .
. .
.
 .
.