题目内容
13.下列说法正确的是( )| A. | H2Se的沸点高于H2S,可推测PH3的沸点高于NH3 | |
| B. | 17g羟基(-OH)所含有的电子数是9NA | |
| C. | σ键是镜面对称,而π键是轴对称 | |
| D. | 标准状况下,11.2 L三氯甲烷所含分子数为0.5 NA |
分析 A、NH3分子间存在氢键;
B、求出羟基的物质的量,然后根据1mol羟基含9mol电子来分析;
C、σ键是球对称,π键为镜面对称;
D、标况下,三氯甲烷为液体.
解答 解:A、NH3分子间存在氢键,导致熔沸点比PH3的沸点高,故A错误;
B、17g羟基的物质的量为1mol,而1mol羟基含9mol电子,个数为9NA个,故B正确;
C、σ键“头碰头”重叠为球对称,π键“肩并肩”重叠为镜面对称,故C错误;
D、标况下,三氯甲烷为液体,不能根据气体摩尔体积来计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意的是σ键是球对称,π键为镜面对称.

练习册系列答案
相关题目
4.下列说法不正确的是( )
①有机物都是含碳、氢的混合物
②六大营养素都是有机物
③有机物都易燃烧
④有机物都是非电解质
⑤分子中只含C-C和C-H键的化合物一定是烷烃
⑥含苯环的化合物一定是芳香烃.
①有机物都是含碳、氢的混合物
②六大营养素都是有机物
③有机物都易燃烧
④有机物都是非电解质
⑤分子中只含C-C和C-H键的化合物一定是烷烃
⑥含苯环的化合物一定是芳香烃.
| A. | ①②③④⑤⑥ | B. | ①②③⑥ | C. | ②③④⑤ | D. | ①②③④⑤ |
18.a LFeSO4溶液中含Fe2+bg,将aL上述溶液稀释为原来3倍,则所得溶液中SO42-的物质的量浓度为( )mol/L.
| A. | $\frac{56b}{a}$ | B. | $\frac{b}{168a}$ | C. | $\frac{3b}{168a}$ | D. | $\frac{b}{56a}$ |
5.下列实验装置(固定装置略去)和操作正确( )
| A. | 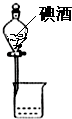 分离碘酒中的碘 | B. | 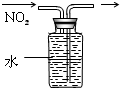 排水法收集NO2 | ||
| C. | 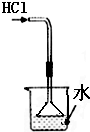 吸收HCl尾气 | D. | 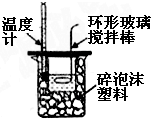 中和热的测定 |
2.下列事实中,不能用勒沙特列原理解释的是( )
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 工业合成氨时选择铁做催化剂能极大加快反应速率 | |
| C. | 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 | |
| D. | 工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
3.下列说法正确的是( )
| A. | 化合反应都是氧化还原反应 | |
| B. | 复分解反应都不是氧化还原反应 | |
| C. | 在反应 2H2S+SO2=3S+2H2O中,还原剂是SO2 | |
| D. | 在一个氧化还原反应中,同一种反应物不可能既是氧化剂又是还原剂 |
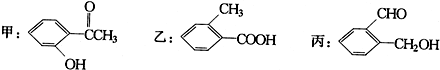
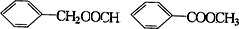 .
.