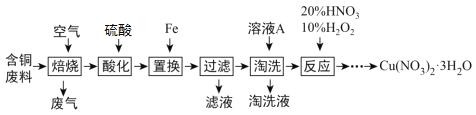
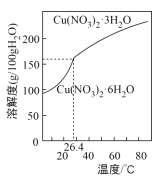
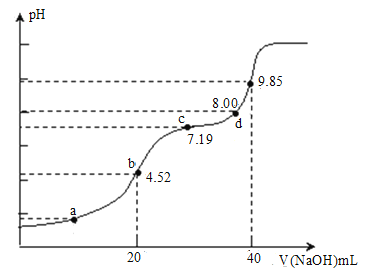
题目内容
【题目】(1)比较熔点:![]() 晶体_______白磷晶体(填“>”、“<”或“=”),判断的理由是_______________;
晶体_______白磷晶体(填“>”、“<”或“=”),判断的理由是_______________;
(2)酸碱质子理论认为,能电离出质子(氢离子)的物质是酸,能结合质子的物质是碱,用一个离子方程式说明:![]() 与
与![]() 的碱性强弱________________;
的碱性强弱________________;
(3)一水合氨![]() 分子中,
分子中,![]() 与
与![]() 实际上是通过氢键相结合,请结合一水合氨的性质,用结构式画出一水合氨最有可能的分子结构____________。
实际上是通过氢键相结合,请结合一水合氨的性质,用结构式画出一水合氨最有可能的分子结构____________。
【答案】> 晶体硅为原子晶体,熔化时破坏共价键,白磷为分子晶体,熔化时破坏分子间作用力 ![]()
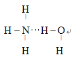
【解析】
(1)一般熔点为原子晶体>分子晶体,晶体硅为原子晶体,熔化时破坏共价键,白磷为分子晶体,熔化时破坏分子间作用力,故熔点:![]() 晶体大于白磷晶体;
晶体大于白磷晶体;
(2)![]() 结合质子生成
结合质子生成![]() ,
,![]() 结合质子生成
结合质子生成![]() ,二者碱性强弱比较可通过强制弱的原理,
,二者碱性强弱比较可通过强制弱的原理,![]() 能结合
能结合![]() 电离出的氢离子生成
电离出的氢离子生成![]() 和
和![]() ,故通过方程式
,故通过方程式
![]() 能说明碱性
能说明碱性![]() 大于
大于![]() ;
;
(3)![]() 分子中N和H形成共价单键,
分子中N和H形成共价单键,![]() 中H和O形成共价单键,当
中H和O形成共价单键,当![]() 溶于水时,由于N、O具有很强非金属性,容易形成氢键,结合一水合氨的性质,能电离出OH-,故最可能的结合方式为氨分子中的N与水分子中的H形成氢键,结构式为
溶于水时,由于N、O具有很强非金属性,容易形成氢键,结合一水合氨的性质,能电离出OH-,故最可能的结合方式为氨分子中的N与水分子中的H形成氢键,结构式为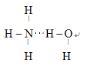 。
。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】氢气是一种重要的清洁能源。
(1)航天员呼吸产生的![]() 利用
利用![]() 反应:
反应:![]() H,再电解水可实现
H,再电解水可实现![]() 的循环利用。
的循环利用。
①热力学中规定,由最稳定单质生成![]() 某物质的焓变称为该物质的标准生成焓(符号:
某物质的焓变称为该物质的标准生成焓(符号:![]() ),最稳定单质的标准生成焓规定为0。已知上述反应式中:
),最稳定单质的标准生成焓规定为0。已知上述反应式中:
![]() ;
;![]() ;
;![]() ;
;
![]() ;则
;则![]() _____
_____![]() 。
。
②![]() 反应必须在高温下才能进行,原因是___________________________。
反应必须在高温下才能进行,原因是___________________________。
③350℃时,向体积为![]() 的恒容密闭容器中通入
的恒容密闭容器中通入![]() 和
和![]() 发生以上反应。
发生以上反应。
测得反应过程中压强随时间的变化如下表所示:
时间/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强 |
|
|
|
|
|
|
|
350℃时![]() 反应的
反应的![]() ______(
______(![]() 为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
(2)利用乙醇重整制氢是获得氢能的研究热点,其主要反应原理为:
反应Ⅰ: ![]() H1
H1
若同时通入水蒸汽,还会发生如下反应
反应Ⅱ:![]() H2
H2
反应Ⅲ:![]() H3
H3
反应Ⅳ:![]() H4
H4
一定温度下,某恒压密闭容器中充入一定量的![]() 发生反应。
发生反应。
已知:氢气选择性指转化的原料气中,转化成氢气的氢元素质量与转化的氢元素总质量的比值。
①下列有关说法正确的是_______________。
A.当混合气的平均相对分子质量不变时,说明反应达到平衡状态
B.增大乙醇初始浓度,能够提高乙醇的平衡转化率
C.其它条件不变,掺入稀有气体,可提高乙醇平衡转化率
D.其它条件不变,掺入水蒸气,可提高氢气的选择性和氢气的体积分数
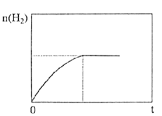
②下图为上述条件下n(H2)随反应时间的变化曲线图。若其它初始条件相同,只把容器变为恒容密闭容器,请画出恒容条件下,n(H2)随反应时间的变化曲线图________________。
③乙醇重整制氢过程中,还可能生成固态炭,固态炭的生成会造成催化剂失活,应尽量避免。研究其它条件相同下,反应温度、氧醇比、水醇比与生成固态炭的条件,得到下图:
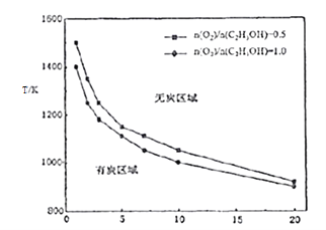
试根据图象分析,反应温度、氧醇比、水醇比对固态炭生成的影响_____________。