题目内容
【题目】在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【答案】A
【解析】
依据题意可知,
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJmol-1 ①,
C(s)+O2(g)=CO2(g) △H=-393.5kJmol-1 ②,
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJmol-1 ③,
由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(l),
其反应热为2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1=-488.3kJmol-1,A项正确;
答案选A。

 阅读快车系列答案
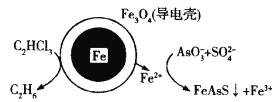
阅读快车系列答案【题目】氮化硼![]() 广泛应用于制造合金、耐高温材料和半导体。科研小组以富硼废料(主要成分为
广泛应用于制造合金、耐高温材料和半导体。科研小组以富硼废料(主要成分为![]() 和
和![]() ,还含有少量
,还含有少量![]() 等)为原料,制备氮化硼的一种工艺流程如下:
等)为原料,制备氮化硼的一种工艺流程如下:
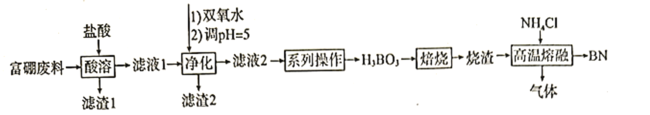
已知:硼酸溶于水和乙醇,在水中的溶解度如下
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度( | 2.77 | 4.78 | 8.90 | 14.89 | 23.54 | 39.60 |
回答下列问题:
(1)“酸溶”时需控制适当温度,温度不能过高的原因为____________________________;除控制适当温度外,可加快“酸溶”速率的措施还有__________________(答出一点即可)。
(2)“净化”时第一步反应的化学方程式为__________________;第二步调![]() 的目的为_______________;滤液2中
的目的为_______________;滤液2中![]() _______________(已知
_______________(已知![]() )
)
(3)“系列操作”中,洗涤结晶出来的硼酸的操作为__________________________。
(4)“高温熔融”过程中生成的气体为两种氢化物,则主要反应的化学方程式为__________________________;生成的气体用水吸收后可返回__________________________工序循环利用。
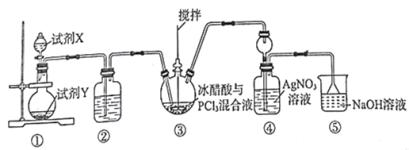
【题目】某兴趣小组制备一定量的乙酸乙酯.取3mL无水乙醇,2mL浓硫酸,2mL冰醋酸进行实验,用5mL饱和碳酸钠溶液收集产物。
I.实验装置如图所示
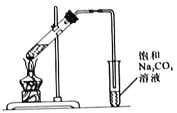
(1)制备乙酸乙酯的化学方程式为_______________。
(2)浓硫酸的作用是_______________。
(3)长导管的作用是_______________。
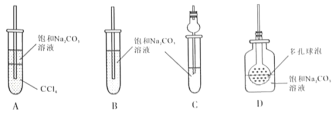
(4)接收装置还可选择下图中的___________。(填序号).
Ⅱ.甲同学用含有酚酞的饱和碳酸钠溶液(呈碱性)收集产物后振荡,发现红色迅速退去.
甲同学认为是蒸出的乙酸中和了碳酸钠.乙同学通过查阅资料并进行如下实验,证明甲同学的推测是错误的。
已知:酚酞难溶于水,易溶于有机溶剂;酚酞试剂是酚酞的乙醇溶液.
实验i,取振荡后的下层无色液体,分成两份,分别完成以下实验
序号 | 实验操作 | 实验现象 | 结论 |
1 | 滴加几滴酸酞试剂 | 溶液 ① (填“变红”成“不变红”) | 碳酸钠并未被乙酸完全中和,仍有大量剩余 |
2 | 滴入乙酸溶液 | 有大量气泡产生 |
实验ii.取振荡后的上层液体,加入 ② 溶液,振荡,发现出现浅红色,静置分层后红色消失。
实验iii,取5mL饱和碳酸钠溶液,滴入几滴酚酞试剂,再加入3mL乙酸乙酯(不含乙酸)振荡,溶液先变红,振荡后红色消失。回答下列问题
(5)完成上述实验:①_______________。②_______________。
(6)结合实验ii和实验iii的现象,可得出的结论是_______________。
(7)实验iii的实验目的是_______________。