题目内容
【题目】工业上由含铜废料(含有Cu、CuS、CuSO4等)制备硝酸铜晶体的流程如图:
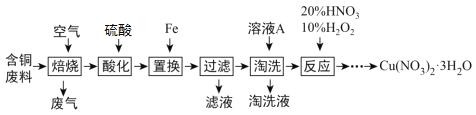
(1)“焙烧”时CuS转化为CuO和SO2,反应的化学方程式为___。
(2)“酸化”步骤反应的离子方程式为___。
(3)“过滤”所得滤液中溶质的主要成分为___。
(4)“淘洗”所用的溶液A应选用___(填序号)。
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(5)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO3和H2O2的物质的量之比为___。
②若不加10% H2O2,只用浓HNO3,随着反应的进行,容器内持续出现大量红棕色气体,写出该反应的离子方程式____。
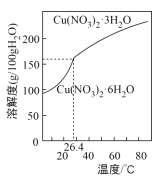
(6)由“反应”所得溶液中尽可能多地析出Cu(NO3)2·3H2O晶体的方法是___。(相关物质的溶解度曲线如图所示)
【答案】2CuS+3O2 ![]() 2CuO+2SO2 CuO+2H+═Cu2++H2O FeSO4 a 2∶1 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 蒸发浓缩,降温至温度略高于26.4°C结晶
2CuO+2SO2 CuO+2H+═Cu2++H2O FeSO4 a 2∶1 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 蒸发浓缩,降温至温度略高于26.4°C结晶
【解析】
工业上由含铜废料(含有Cu、CuS、CuSO4等)制备硝酸铜晶体,废料通入空气焙烧后,铜生成氧化铜,硫化铜转化为CuO和SO2,加入硫酸酸化生成硫酸铜,加入过量的铁发生置换反应生成铜,过滤得到滤渣铁和铜,用溶液A淘洗后加入20%的HNO3和10%的H2O2发生反应,蒸发浓缩,降温至温度略高于26.4°C结晶,从“反应”所得溶液中析出Cu(NO3)23H2O,据此分析解答。
(1)CuS焙烧和氧气反应转化为CuO和SO2,反应的化学方程式为:2CuS+3O2 ![]() 2CuO+2SO2,故答案为:2CuS+3O2
2CuO+2SO2,故答案为:2CuS+3O2 ![]() 2CuO+2SO2;
2CuO+2SO2;
(2)酸化过程为经过焙烧得到的氧化铜与稀硫酸反应生成铜离子,离子方程式为:CuO+2H+═Cu2++H2O,故答案为:CuO+2H+═Cu2++H2O;
(3)根据上述分析可知,过滤得到滤液主要为硫酸亚铁溶液,故答案为:FeSO4;
(4)淘洗加入的酸不能具有强氧化性,否则会溶解铜。a.稀硫酸,不能和铜反应,故a选;b.浓硫酸和铜在常温下不反应,但浓硫酸稀释会放出大量热,会和铜发生反应,故b不选;c.稀硝酸具有氧化性能溶解铜,故c不选;d.浓硝酸能溶解铜,故d不选;故答案为:a;
(5)①“反应”一步所用的试剂是20%HNO3和10%H2O2,硝酸做酸,过氧化氢做氧化剂将Cu氧化生成硝酸铜,反应的化学方程式为:Cu+H2O2+2HNO3=Cu(NO3)2+2H2O,理论上消耗HNO3和H2O2的物质的量之比为2∶1,故答案为:2∶1;
②若不加10%H2O2,只用浓HNO3,铜和浓硝酸反应生成二氧化氮气体,反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(6)根据图像中结晶水合物的溶解度随温度变化曲线可知,温度高于26.4°C从“反应”所得溶液中析出Cu(NO3)23H2O,从“反应”所得溶液中析出Cu(NO3)23H2O的方法是:蒸发浓缩,降温至温度略高于26.4°C结晶,故答案为;蒸发浓缩,降温至温度略高于26.4°C结晶。