题目内容
【题目】某密闭容器中发生如下反应:2X(g)+Y(g) ![]() 2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是( )
2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是( )
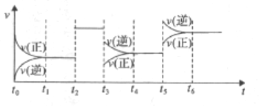
A. t3时降低了温度 B. t5时增大了压强
C. t6时刻后反应物的转化率最低 D. t4时该反应的平衡常数小于t6时反应的平衡常数
【答案】C
【解析】
A.该反应 △H<0,若t3时降低了温度,平衡将右移,且速率减慢、正反应速率大于逆反应速率,与图示的不符,A错误;
B.该反应为体积减小的反应,若t5时增大了压强,速率将加快,且平衡右移、正反应速率大于逆反应速率,与图示的不符,B错误;
C.t2-t3 为使用催化剂,平衡不移动,转化率不变;t3-t4为减小压强,平衡左移,转化率减小,t5-t6为升高温度,平衡左移,转化率减小,因此整个过程中,t6时刻后反应物的转化率最低,C正确;
D. 该反应的正反应是放热反应,升高温度,平衡常数减小;相对于t4时,t6时为升温过程,平衡左移,所以t4时该反应的平衡常数大于t6时反应的平衡常数,D错误;
综上所述,本题选C。

 阅读快车系列答案
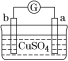
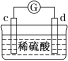
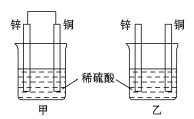
阅读快车系列答案【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)(2)小题用元素符号或化学式回答,(3)~(5)小题按题目要求回答。
族 周期 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中A~I元素中,化学性质最不活泼的是________,只有负价而无正价的是_________,氧化性最强的单质是_______,还原性最强的单质是____________。
(2)在B、C、E、F、G、H中,原子半径最大的是__________________。
(3)最高价氧化物的水化物碱性最强的化合物的电子式是___________。
(4)A和D组成最简单的化合物的电子式是_____________________。
(5)用电子式表示B和H组成化合物的形成过程_____________________。