题目内容
【题目】氢气是一种重要的清洁能源。
(1)航天员呼吸产生的![]() 利用
利用![]() 反应:
反应:![]() H,再电解水可实现
H,再电解水可实现![]() 的循环利用。
的循环利用。
①热力学中规定,由最稳定单质生成![]() 某物质的焓变称为该物质的标准生成焓(符号:
某物质的焓变称为该物质的标准生成焓(符号:![]() ),最稳定单质的标准生成焓规定为0。已知上述反应式中:
),最稳定单质的标准生成焓规定为0。已知上述反应式中:
![]() ;
;![]() ;
;![]() ;
;
![]() ;则
;则![]() _____
_____![]() 。
。
②![]() 反应必须在高温下才能进行,原因是___________________________。
反应必须在高温下才能进行,原因是___________________________。
③350℃时,向体积为![]() 的恒容密闭容器中通入
的恒容密闭容器中通入![]() 和
和![]() 发生以上反应。
发生以上反应。
测得反应过程中压强随时间的变化如下表所示:
时间/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强 |
|
|
|
|
|
|
|
350℃时![]() 反应的
反应的![]() ______(
______(![]() 为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
(2)利用乙醇重整制氢是获得氢能的研究热点,其主要反应原理为:
反应Ⅰ: ![]() H1
H1
若同时通入水蒸汽,还会发生如下反应
反应Ⅱ:![]() H2
H2
反应Ⅲ:![]() H3
H3
反应Ⅳ:![]() H4
H4
一定温度下,某恒压密闭容器中充入一定量的![]() 发生反应。
发生反应。
已知:氢气选择性指转化的原料气中,转化成氢气的氢元素质量与转化的氢元素总质量的比值。
①下列有关说法正确的是_______________。
A.当混合气的平均相对分子质量不变时,说明反应达到平衡状态
B.增大乙醇初始浓度,能够提高乙醇的平衡转化率
C.其它条件不变,掺入稀有气体,可提高乙醇平衡转化率
D.其它条件不变,掺入水蒸气,可提高氢气的选择性和氢气的体积分数
②下图为上述条件下n(H2)随反应时间的变化曲线图。若其它初始条件相同,只把容器变为恒容密闭容器,请画出恒容条件下,n(H2)随反应时间的变化曲线图________________。
③乙醇重整制氢过程中,还可能生成固态炭,固态炭的生成会造成催化剂失活,应尽量避免。研究其它条件相同下,反应温度、氧醇比、水醇比与生成固态炭的条件,得到下图:
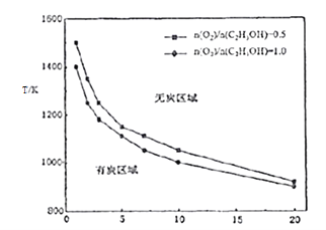
试根据图象分析,反应温度、氧醇比、水醇比对固态炭生成的影响_____________。
【答案】-90 反应的活化能高 ![]() AC
AC 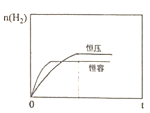 在其它条件相同的情况下,升高温度或增大水醇比、增大氧醇比均会减少固态炭的生成。
在其它条件相同的情况下,升高温度或增大水醇比、增大氧醇比均会减少固态炭的生成。
【解析】
计算反应的焓变时,应将生成物的焓变减去反应物的焓变;对于一个反应,不管是吸热反应还是放热反应,都需要提供能量引发反应,反应的活化能越高,所需能量越大;用分压表示平衡常数时,可利用三段式,先求出平衡时各物质的分压,再代入平衡常数计算公式。对于可逆反应,分析平衡混合气的相对分子质量变化时,需要考察气体的总质量和总物质的量的变化;判断反应物的转化率时,需考虑平衡移动的方向;判断产物中H2的体积分数时,不能只考虑生成物中H2的含量,还需考虑反应物的转化率。分析图象时,一方面需考虑条件改变引起反应时间的改变,另一方面需考虑平衡移动的方向;分析条件改变对某产物产量的影响时,需从图象分析入手,找出理想的区域,从而得出适宜的条件。
(1)①![]() 反应:
反应:![]() H
H
![]() ;
;![]() ;
;![]() ;
;
![]() ;则H =2
;则H =2![]() -
-![]() =2×(-242kJmol-1)-(-394 kJmol-1)= -90 kJmol-1。答案为:-90;
=2×(-242kJmol-1)-(-394 kJmol-1)= -90 kJmol-1。答案为:-90;
②反应时提供的条件,是为了克服反应的活化能,![]() 反应必须在高温下才能进行,原因是反应的活化能高。答案为:反应的活化能高;
反应必须在高温下才能进行,原因是反应的活化能高。答案为:反应的活化能高;
③设参加反应的CO2物质的量为x,利用已知数据可建立如下三段式:
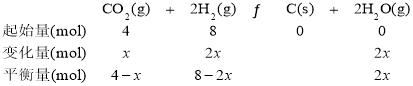
则![]() ,x=2mol,350℃时
,x=2mol,350℃时![]() 反应的Kp=
反应的Kp=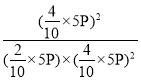 =
=![]() 。答案为:
。答案为:![]() ;
;
(2)①A.随着反应的进行,混合气的质量不变,物质的量不断改变,当混合气的平均相对分子质量不变时,物质的量保持不变,说明反应达到平衡状态,A符合题意;
B.增大乙醇初始浓度,相当于加压,平衡逆向移动,乙醇的平衡转化率降低,B不合题意;
C.其它条件不变,掺入稀有气体,由于容器的压强不变,气体的体积增大,反应混合气的浓度减小,相当于减压,平衡正向移动,乙醇平衡转化率提高,C符合题意;
D.其它条件不变,掺入水蒸气,反应物中的氢元素都转化为H2,可提高氢气的选择性,但各可逆反应的转化率未知,所以氢气的体积分数不一定增大,D不合题意;
故选AC。答案为:AC;
②若其它初始条件相同,只把容器变为恒容密闭容器,由于生成物的气体分子数大于反应物的气体分子数,所以相当于原容器加压,反应速率加快,达平衡的时间缩短,但平衡逆向移动,n(H2)减小,故恒容条件下,n(H2)随反应时间的变化曲线图为 。答案为:
。答案为: ;
;
③从图象中可以看出,温度一定时,增大氧醇比、水醇比,会减少固态炭生成;氧醇比、水醇比一定时,升高温度,会减少固态炭生成,所以反应温度、氧醇比、水醇比对固态炭生成的影响:在其它条件相同的情况下,升高温度或增大水醇比、增大氧醇比均会减少固态炭的生成。答案为:在其它条件相同的情况下,升高温度或增大水醇比、增大氧醇比均会减少固态炭的生成。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案