题目内容
【题目】H2S是一种剧毒气体,工业生产中可以通过多种手段对其进行回收或再利用。
Ⅰ.900℃时可以用克劳斯法回收H2S气体,该过程中涉及的部分反应如下:
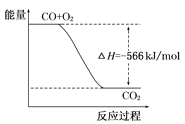
①2H2S(g)+O2(g)![]() S2(g)+2H2O(g) △H=-316.8kJmol-1
S2(g)+2H2O(g) △H=-316.8kJmol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=-1040.2kJmol-1
(1)4H2S(g)+2SO2(g)![]() 3S2(g)+4H2O(g)的△H=___
3S2(g)+4H2O(g)的△H=___
(2)若在900℃以上绝热、恒容的密闭容器中,投入一定量的H2S、O2发生反应①,下列说法能说明反应达到平衡状态的是___
a.混合气体密度不随时间变化而变化
b.v正(O2)=2v逆(H2O)
c.体系压强不随时间变化而变化
d.反应体系温度不变
e.混合气体平均相对分子质量不变
f.单位时间内生成nmolS2,同时生成2nmolH2S
Ⅱ.工业上还可以通过硫化氢分解对其进行处理、利用:2H2S(g)![]() S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图1所示:
S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图1所示:
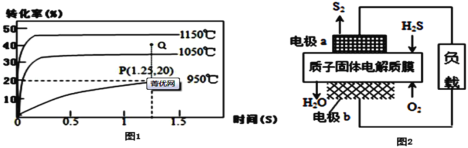
(3)950℃时,0~1.25s生成S2(g)的平均反应速率为___
(4)该反应的△H___0(填“>”“<”或“=”),1050℃达到平衡时H2S的转化率为35%,则该温度下,平衡常数K=___(保留一位有效数字),该温度下Q点时反应___(填“正向移动”“逆向移动”或“不移动”)
Ⅲ.对H2S废气进行利用的另一种途径是将其设计成质子膜—H2S燃料电池,反应原理为2H2S(g)+O2(g)═S2(s)+2H2O(l)。电池结构示意图如图2:
(5)电极a上发生的电极反应式为___。
(6)设NA为阿伏伽德罗常数的值,当电路中通过3mol电子时,通过质子膜进入___(填“正极区”或“负极区”)的H+数目为___。
【答案】+89.8kJmol-1 cdf 0.004molL-1s-1 > 0.003 逆向移动 2H2S-4e-=S2+4H+ 正极区 3NA
【解析】
根据盖斯定律进行ΔH的计算,分析条件是否为“变量”判断能否作为达到平衡的标志,根据公式![]() 计算化学反应速率,结合三段式计算平衡常数,根据原电池原理书写电极反应方程式并进行相关计算。
计算化学反应速率,结合三段式计算平衡常数,根据原电池原理书写电极反应方程式并进行相关计算。
Ⅰ.(1)已知①2H2S(g)+O2(g)![]() S2(g)+2H2O(g)△H=-316.8kJmol-1
S2(g)+2H2O(g)△H=-316.8kJmol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)△H=-1040.2kJmol-1
根据盖斯定律,反应①×3-②可得反应4H2S(g)+2SO2(g)![]() 3S2(g)+4H2O(g),则△H=(-316.8kJmol-1)×3-(-1040.2kJmol-1)=+89.8 kJmol-1;
3S2(g)+4H2O(g),则△H=(-316.8kJmol-1)×3-(-1040.2kJmol-1)=+89.8 kJmol-1;
(2)绝热、恒容的密闭容器中,对于反应2H2S(g)+O2(g)![]() S2(g)+2H2O(g):
S2(g)+2H2O(g):
a.由质量守恒可知反应前后气体总质量不变,又恒容密闭容器,则无论反应是否达到平衡,混合气体的密度始终不变,a不符合题意;
b.根据化学反应速率与化学计量数成正比分析可知,2v正(O2)=v逆(H2O)时,反应正逆反应速率相等,而v正(O2)=0.5v正(H2O)<2v逆(H2O),反应逆向进行,b不符合题意;
c.反应①为放热反应,绝热密闭容器中,随着反应的进行,温度上高,压强增大,则反应体系压强不随时间变化而变化时,说明反应达到平衡,c符合题意;
d.反应①为放热反应,绝热密闭容器中,随着反应的进行,温度上高,当反应体系温度不变时,说明反应达到平衡,d符合题意;
e.反应前后气体的物质的量不变,总质量不变,则混合气体平均相对分子质量始终不变,不能说明反应达到平衡,e不符合题意;
f.单位时间内生成nmolS2,同时生成2nmolH2S,则正逆反应速率相等,说明反应达到平衡,f符合题意;
故答案为:cdf;
Ⅱ.(3)根据图1数据可知,950℃时,0~1.25s内H2S的转化率为20%,则反应了0.1×20%=0.02molH2S,根据方程式可知生成了0.01molS2,则生成S2的平均反应速率 ;
;
(4)由图可知,升高温度,H2S的转化率增大,即反应正向进行,则正反应为吸热反应,ΔH>0,1050℃达到平衡时H2S的转化率为35%,则可列平衡三段式为:

平衡常数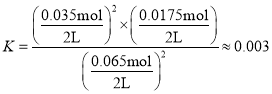 ,该温度下,Q点时,转化率增大,所以Qc>K,平衡逆向移动;
,该温度下,Q点时,转化率增大,所以Qc>K,平衡逆向移动;
Ⅲ.(5)根据电池工作原理图分析可知,H2S在电极a失去电子发生氧化反应生成S2,则电极a为原电池负极,电极反应为2H2S-4e-=S2+4H+;
(6)原电池中阳离子向正极移动,根据电极a的电极反应2H2S-4e-=S2+4H+可知,当电路中通过3mol电子时,3molH+通过质子膜进入正极区,数目为3NA。

【题目】一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
下列说法不正确的是( )
A.前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B.达到平衡时,需要从外界吸收的能量为0.968 kJ
C.增大水的浓度,可以改变待反应的限度
D.使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数