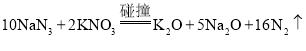题目内容
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
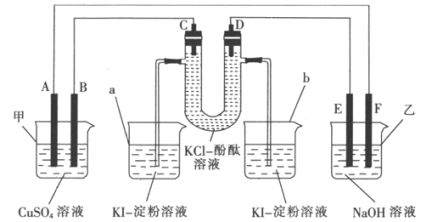
(1)判断装置的名称:甲池为_________(填“电解池”或“原电池”,下同),乙池为_________。
(2)B极为_________ (填“正极”或“负极”或“阳极”或“阴极”,下同),电极反应式为_________;F极为_________,电极反应式为__________________。
(3)U形管中溶液先变红的是_________(填“C”或“D”)极,U形管中发生反应的化学方程式为________________________________________。
(4)当烧杯中有38.1 g I2(KI足量)生成时,甲池中溶液的质量会减少________g。
【答案】电解池 原电池 阴极 Cu2++2e-=Cu 正极 2H++2e-=H2↑ D 2KCl+2H2O![]() 2KOH+H2↑+Cl2↑ 12
2KOH+H2↑+Cl2↑ 12
【解析】
A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应,则E为铝,F为镁。根据图示,装置乙为原电池,在镁、铝(NaOH溶液)原电池中铝为负极,镁为正极,即E为负极,F为正极,因此,D、B为阴极,A、C为阳极。
(1)根据上述分析,甲池是电解池;乙池是原电池,故答案为:电解池;原电池;
(2)B极与原电池的负极相连,为阴极,铜离子得电子产生铜,电极反应式为Cu2++2e-=Cu;F极为正极,氢离子得电子产生氢气,电极反应式为2H++2e-=H2↑;
(3)U形管中D连接负极作为阴极,氢离子得电子产生氢气,氢氧根离子浓度增大,遇酚酞变红,则溶液先变红的是D极,U形管中为电解氯化钾溶液,发生反应的化学方程式为2KCl+2H2O![]() 2KOH+H2↑+Cl2↑;
2KOH+H2↑+Cl2↑;
(4)当烧杯中有38.1 g I2(KI足量)生成时,转移电子数为2×![]() =0.3mol,甲池为电解硫酸铜溶液,电极总反应为2CuSO4+2H2O
=0.3mol,甲池为电解硫酸铜溶液,电极总反应为2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,根据得失电子守恒可知,溶液的质量会减少0.3mol ×
2Cu+2H2SO4+O2↑,根据得失电子守恒可知,溶液的质量会减少0.3mol ×![]() g/mol=12g。
g/mol=12g。

 名校课堂系列答案
名校课堂系列答案【题目】脱硝技术是处理氮氧化物的有效方法之一。在1L的恒容密闭容器中充入2mol NH3、1mol NO和1mol NO2,发生反应:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
0 | 10 min | 20 min | 30 min | 40 min | |
T1K | 0 | 0.6 | 1.1 | 1.5 | 1.5 |
T2K | 0 | 0.8 | 1.4 | 1.4 | 1.4 |
回答下列问题:
(1)上述反应中___________(填字母)。
A. △S>0,△H>0 B. △S>0,△H<0 C. △S<0,△H>0 D. △S<0,△H<0
(2)T1_______(填“>”“<”或“=”)T2,理由是___________________________________________
(3)T1K下,0~20min内v(NO)=______________
(4)T2K下,NO2的平衡转化率为_____________