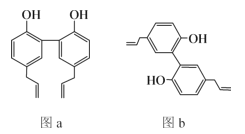
题目内容
【题目】叠氮化钠(NaN3)与硝酸钾碰撞时发生的反应为: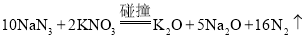 。若有1 mol N2生成,则下列判断正确的是
。若有1 mol N2生成,则下列判断正确的是
A.生成N2的体积一定为22.4 LB.有0. 125 mol KNO3被氧化
C.Na2O为氧化产物,N2为还原产物D.转移电子的物质的量为0.625 mol
【答案】D
【解析】
用双线桥表示该反应的电子转移情况如下:
 ,可在此基础上进行判断。
,可在此基础上进行判断。
A. 气体的体积受温度和压强的影响,没有指明温度和压强无法计算气体体积,A选项错误;
B. KNO3得电子,被还原,B选项错误;
C. 从分析可知,Na2O既不是氧化产物,也不是还原产物,N2既是氧化产物,又是还原产物,C选项错误;
D. 若有1 mol N2生成,转移电子的物质的量为![]() ,D选项正确;
,D选项正确;
答案选D。

【题目】请运用化学反应原理的相关知识回答下列问题:
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为_________________。该反应的△S ________0(选填“>”、“<”或“=”),该反应在_______条件下能自发进行(选填“高温”、“低温”或“任意温度”)。
(2)CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =____________。
②工业上高炉炼铁反应的平衡常数表达式K =______,温度升高后,K值_______(选填“增大”、“不变”或“减小”)。
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
下列说法正确的是____________(填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)请解释打开饮料“雪碧”的瓶盖,会有大量气泡冒出的原因:_____________.
(4)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。正极加入的物质是______;负极的电极反应是_______________。