题目内容
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数之比为2:3.试回答下列问题:
(1)E元素在周期表中的位置是 ;
(2)已知101KPa时,A单质的燃烧热为285.8kJ/m01,请写出A单质完全燃烧生成液态水时的热化学方程式: ;
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成.
①X、Y均属于 化合物(填“离子”或“共价”):
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成.其离子反应方程式为: .
(1)E元素在周期表中的位置是
(2)已知101KPa时,A单质的燃烧热为285.8kJ/m01,请写出A单质完全燃烧生成液态水时的热化学方程式:
(3)E单质在足量D单质中燃烧生成的化合物的电子式是
(4)化合物X、Y均由A、D、E、F四种元素组成.
①X、Y均属于
②X与Y的水溶液相混合发生反应的离子方程式为
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成.其离子反应方程式为:
分析:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A原子核内无中子,则A为H元素;A和E、D和F分别同主族,且小于E元素的原子序数有多种,则E是Na元素,F为原子序数大于E的短周期元素,F位于第三周期,D和F同主族,则D位于第二周期;
如果D的最外层电子数为3,B为He元素时,D为B元素,Na不能在硼的单质中燃烧,故错误;
所以D的最外层电子数是6,为O元素,B的最外层电子数是4,为C元素,则C为N元素,D和F位于同一主族,则F为S元素,结合物质的结构和性质分析解答.
如果D的最外层电子数为3,B为He元素时,D为B元素,Na不能在硼的单质中燃烧,故错误;
所以D的最外层电子数是6,为O元素,B的最外层电子数是4,为C元素,则C为N元素,D和F位于同一主族,则F为S元素,结合物质的结构和性质分析解答.
解答:解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A原子核内无中子,则A为H元素;A和E、D和F分别同主族,且小于E元素的原子序数有多种,则E是Na元素,F为原子序数大于E的短周期元素,F位于第三周期,D和F同主族,则D位于第二周期;
如果D的最外层电子数为3,B为He元素时,D为B元素,Na不能在硼的单质中燃烧,故错误;
所以D的最外层电子数是6,为O元素,B的最外层电子数是4,为C元素,则C为N元素,D和F位于同一主族,则F为S元素,
(1)钠原子核外有3个电子层,最外层有1个电子,所以钠元素位于第三周期第IA族,故答案为:第三周期第IA族;
(2)A单质的燃烧热为285.8kJ/m01,即1mol氢气完全燃烧生成液态水时放出285.8KJ,所以其热化学反应方程式为:H2(g)+
O2(g)═H2O(l)△H=-285.8KJ/mol,
故答案为:H2(g)+
O2(g)═H2O(l)△H=-285.8KJ/mol;
(3)E是Na,D的单质为氧气,钠在氧气中燃烧生成过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,所以其电子式为: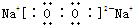 ,故答案为:
,故答案为: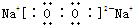 ;
;
(4)化合物X、Y均由A、D、E、F四种元素组成,
①这几种元素形成的化合物中,钠离子和酸根离子能形成离子键,所以为离子化合物,故答案为:离子;
②由这四种元素形成的化合物有亚硫酸氢钠和硫酸氢钠,硫酸氢钠为强酸性溶液,能和弱酸的酸式盐反应,所以亚硫酸氢根离子和氢离子反应生成二氧化硫和水,离子反应方程式为:H++HSO3-═H2O+SO2↑,故答案为:H++HSO3-═H2O+SO2↑;
(5)化合物Na2S具有氧化性,双氧水具有氧化性,酸性条件下,二者发生氧化反应生成硫单质和水,所以离子反应方程式为:S2-+H2O2+2H+═S↓+2H2O,
故答案为:S2-+H2O2+2H+═S↓+2H2O.
如果D的最外层电子数为3,B为He元素时,D为B元素,Na不能在硼的单质中燃烧,故错误;
所以D的最外层电子数是6,为O元素,B的最外层电子数是4,为C元素,则C为N元素,D和F位于同一主族,则F为S元素,
(1)钠原子核外有3个电子层,最外层有1个电子,所以钠元素位于第三周期第IA族,故答案为:第三周期第IA族;
(2)A单质的燃烧热为285.8kJ/m01,即1mol氢气完全燃烧生成液态水时放出285.8KJ,所以其热化学反应方程式为:H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(3)E是Na,D的单质为氧气,钠在氧气中燃烧生成过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,所以其电子式为:
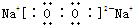 ,故答案为:
,故答案为: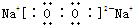 ;
;(4)化合物X、Y均由A、D、E、F四种元素组成,
①这几种元素形成的化合物中,钠离子和酸根离子能形成离子键,所以为离子化合物,故答案为:离子;
②由这四种元素形成的化合物有亚硫酸氢钠和硫酸氢钠,硫酸氢钠为强酸性溶液,能和弱酸的酸式盐反应,所以亚硫酸氢根离子和氢离子反应生成二氧化硫和水,离子反应方程式为:H++HSO3-═H2O+SO2↑,故答案为:H++HSO3-═H2O+SO2↑;
(5)化合物Na2S具有氧化性,双氧水具有氧化性,酸性条件下,二者发生氧化反应生成硫单质和水,所以离子反应方程式为:S2-+H2O2+2H+═S↓+2H2O,
故答案为:S2-+H2O2+2H+═S↓+2H2O.
点评:本题考查了元素位置结构和性质的关系,正确推断元素是解本题关键,注意B元素的确定时要考虑He元素,要通过其它信息排除He元素,再结合物质的性质分析解答,难度中等.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.