题目内容
13.下列有关物质性质的比较中,正确的是( )| A. | 熔点:CO2<H2O<SiO2<KCl | B. | 还原性:S2->I->Br->Cl- | ||
| C. | 酸性:H3PO4>H2SO4>HClO4>H2SiO3 | D. | 稳定性:H2O<NH3<PH3<SiH4 |
分析 A.晶体熔沸点:原子晶体>离子晶体>分子晶体,含有氢键的熔沸点较高;
B.元素的非金属性越强,其简单阴离子的还原性较弱;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.晶体熔沸点:原子晶体>离子晶体>分子晶体,含有氢键的熔沸点较高,二氧化硅是原子晶体、KCl是离子晶体,二氧化碳和水是分子晶体,但水中存在氢键,所以熔沸点顺序是CO2<H2O<KCl<SiO2,故A错误;
B.元素的非金属性越强,其简单阴离子的还原性较弱,非金属性Cl>Br>I>S,所以还原性:S2->I->Br->Cl-,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性:HClO4>>H2SO4>H3PO4>H2SiO3,故C错误;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性O>N>P>Si,所以氢化物的稳定性H2O>NH3>PH3>SiH4,故D错误;
故选B.
点评 本题考查同一周期元素性质递变规律及物质熔沸点高低判断,侧重考查元素周期律,明确元素非金属性与其简单阴离子还原性强弱、最高价氧化物的水化物酸性强弱、氢化物的稳定性关系即可解答,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
4.航天科学技术测得,三氧化二碳(C2O3) 是金星大气层的成分之一.下列说法正确的是( )
| A. | C2O3和CO2是同素异形体 | B. | C2O3和CO完全燃烧,产物都是CO2 | ||
| C. | C2O3和CO 都是酸性氧化物 | D. | C2O3和CO2都是碳酸的酸酐 |
18.下列除杂方法可行的是( )
| A. | 用过量氨水除去AlCl3溶液中的FeCl3 | |
| B. | 用饱和Na2CO3溶液除去CO2中HCl | |
| C. | 用Br2除去KBr溶液中的KCl | |
| D. | 用CuO除去CuCl2中的FeCl3 |
5.可以鉴别乙醇、苯酚、硝酸银、纯碱、氢硫酸五种物质的一种试剂是( )
| A. | 稀盐酸 | B. | 溴水 | C. | 酸性高锰酸钾 | D. | 氯化铁溶液 |
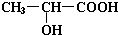 ;
;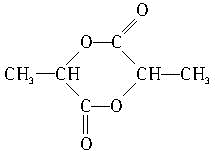 .
.