题目内容
下列事实不能用勒夏特列原理解释的是
| A.配制氯化铁溶液时,加入少量稀盐酸 |
| B.配制氯化亚铁溶液时,加入少量铁屑 |
| C.在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 |
| D.在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
B
解析试题分析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,中这就是勒夏特列原理,该原理适用于所有的平衡体系。A、氯化铁溶于水,铁离子水解,所以配制氯化铁溶液时,加入少量稀盐酸的目的是抑制铁离子水解,A不符合题意;B、亚铁离子极易被氧化生成铁离子,所以配制氯化亚铁溶液时,加入少量铁屑的目的是防止亚铁离子被氧化,与平衡无关系,B符合题意;C、氨水中存在电离平衡,因此在含有酚酞的氨水中加入少量NH4Cl溶液会抑制氨水的电离,溶液的碱性降低颜色会变浅,C不符合题意;D、硫酸铜溶于水存在溶解平衡,因此在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则,D不符合题意,答案选B。
考点:考查勒夏特例原理原理应用的有关判断

 名校课堂系列答案
名校课堂系列答案下列对化学反应方向的叙述,正确的是
| A.室温下不能自发进行的反应,在高温下有可能自发进行 |
| B.熵增加有利于反应的自发进行,熵减少的反应常温下都不会自发进行 |
| C.非自发反应在任何情况下都不会发生 |
| D.ΔH-TΔS作为化学反应方向的判据,在任何条件下都适用 |
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g) CH3OH(g) △H<0;按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是
CH3OH(g) △H<0;按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如右图所示。下列说法正确的是
| A.平衡常数:K(a)>K(c) K(b)=K(d) |
| B.正反应速率:v(a)>v(c) v(b)>v(d) |
| C.平均摩尔质量:M(a)<M(c) M(b)>M(d) |
| D.平衡时a点一定有n(CO):n(H2)=1:2 |
两体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应: X(g)+Y(g) 3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
| A.曲线a是500℃时的图像 |
| B.正反应是吸热反应 |
| C.t3时刻可能是增大了压强 |
| D.t3时刻可能是降低了温度 |
在一定温度下,饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO。下列说法中确的是
H++Cl-+HClO。下列说法中确的是
A.光照一段时间后,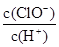 增大 增大 |
| B.加入碳酸钙粉末后,溶液的pH增大 |
| C.加入少量水,由水电离的c(H+)减小 |
| D.加入NaOH固体,一定有c(Na+)>c(Cl-)>c(H+)>c(ClO-)) |
T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:
A(g)+2B (g)  C(g)
C(g)
反应过程中测定的部分数据见下表:
| 反应时间/min | n(A)/mol | n(B)/ mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | | 0.20 |
下列说法正确的是
A.前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C.若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D.温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
 2Z,其平衡常数值为1600
2Z,其平衡常数值为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
在固定体积的密闭容器中进行如下反应:2SO2(g) + O2(g)  2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
| A.SO2、O2分别为0.4mol?L-1、0.2mol?L-1 | B.SO2为0.25mol?L-1 |
| C.SO2、SO3均为0.15mol?L-1 | D.SO3为0.4mol?L-1 |
 2Q(g)+ nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是
2Q(g)+ nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是