题目内容
在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g) 2Q(g)+ nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是
2Q(g)+ nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是
| A.8 | B.6 | C.5 | D.3 |
D
解析试题分析:反应前反应物X、Y气体总体积为7L,达到平衡后混合气体的体积为6.5L,气体体积减小,说明正反应的气体系数减小,符合系数减小的选修只有D,故D项正确。
考点:本题考查化学方程式系数和化学平衡移动的关系。

练习册系列答案
相关题目
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g) PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
| | PCl3(g) | Cl2(g) | PCl5(g) |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
A.10 min内,v(Cl2) =" 0.04" mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的
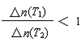
D.平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
氢气既是最理想的能源又是重要的化工原料,用甲烷制氢气是一种廉价的制氢方法。有关的热化学方程式如下: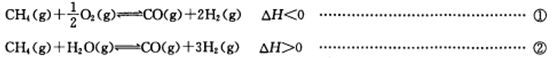
下列说法不正确的是
| A.当反应①中v(CH4)正=v(CO)逆时,表明该反应达平衡状态 |
| B.其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小 |
| C.使用高效催化剂可以加快反应速率,同时提高CH4的转化率 |
| D.同一容器内同时发生反应①与②时,容器内温度可能保持不变 |
某反应其△H="=" -122 kJ/mol,?S="=" 231 J/(mol·K),则此反应在下列哪种情况下可自发进行
| A.在任何温度下都能自发进行 | B.在任何温度下都不能自发进行 |
| C.仅在高温下自发进行 | D.仅在低温下自发进行 |
下列叙述正确的是
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
B.2SO2(g) + O2(g) 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示 |
C.2NO+2CO 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 |
| D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 |
一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)
A(s)+B(g)  C(g)+D(g) ΔH ="+100" kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH ="+100" kJ·mol-1,某时刻测得部分数据如下表:
| 容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
| Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
| Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
| Ⅲ | 0.32 | 1.0 | 0 | 0 | |
| Ⅳ | 0.12 | 0.30 | | | v(正)=v(逆) |
下列说法正确的是 ( )
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ中反应至平衡时吸热20 kJ
D.容器Ⅳ中c(D)=" 0.4" mol·L-1
下列事实不能用勒夏特列原理解释的是
| A.配制氯化铁溶液时,加入少量稀盐酸 |
| B.配制氯化亚铁溶液时,加入少量铁屑 |
| C.在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 |
| D.在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
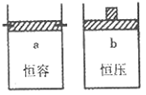
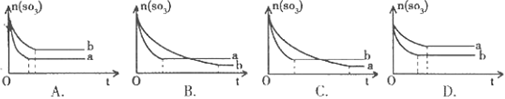
 2SO2(g)+O2(g),两容器中三氧化硫物质的量随时间(t)变化的示意图为
2SO2(g)+O2(g),两容器中三氧化硫物质的量随时间(t)变化的示意图为