题目内容
【题目】某有机物的结构简式如右图 ,若等物质的量的该有机物分别与足量的Na、NaOH、Na2CO3、NaHCO3反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
,若等物质的量的该有机物分别与足量的Na、NaOH、Na2CO3、NaHCO3反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
A. 3 :2 :1 :1 B. 3 :3 :2 :1
C. 2 :2 :1:1 D. 3:2:2:1
【答案】D
【解析】
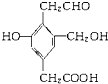 该有机物含酚-OH、醇-OH、-COOH、-CHO,结合酚、醇、羧酸的性质来解答.
该有机物含酚-OH、醇-OH、-COOH、-CHO,结合酚、醇、羧酸的性质来解答.
酚-OH、醇-OH、-COOH均与Na反应,则1mol该有机物与Na反应消耗3molNa,
酚-OH、-COOH与NaOH反应,则1mol该物质消耗2molNaOH,
酚-OH、-COOH与Na2CO3反应,则1mol该有机物消耗2molNa2CO3,
只有-COOH与NaHCO3反应,则1mol该物质消耗1molNaHCO3,
所以Na、NaOH、Na2CO3、NaHCO3分别与等物质的量的该物质恰好反应时,
Na、NaOH、Na2CO3、NaHCO3的物质的量之比为3:2:2:1=3:2:2:1,

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】原子序数依次增加的前四周期的主族元素A~H,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,用相应的化学式回答有关问题:
(1)元素A与C的原子个数比为1:1的化合物的电子式为_______。
(2)元素B、C、D的第一电离能由大到小的顺序为_______
(3)元素C、F形成的阴离子FC32-空间构型为_______
(4)元素G、H的气态氢化物的稳定性由强到弱顺序为________
(5)元素C、F的气态氢化物沸点由高到低的顺序为______,原因是______
(6)元素E的氢化物(EH4)属于_______分子(填“极性”或“非极性”)
(7)铬的基态原子价电子排布式为______。
(8)尿素[H2NCONH2]分子中,C原子的杂化方式为____;1mol尿素分子中,σ键的数目为______。
(9)带有六个结晶水三氯化铁,是橘黄色的晶体,其化学式为[Fe(H2O)6]Cl3,该化合物中,与Fe3+形成配位键的原子是______,写出H2O的一种阴离子的等电子体______






