题目内容
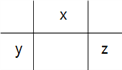
【题目】t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为__________ ;平衡时,SO2 转化率为_____________
(2)下列叙述能证明该反应已达到化学平衡状态的是 __________
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是__________
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为__________。
【答案】 0.1mol.L-1.min-1 20% ABE ACD 80%
【解析】(1)还剩余0.8 mo1氧气可知:反应消耗0.4mol SO2和0.2mol O2,生成0.4mol SO3,三氧化硫的反应速率为v(SO3)= ![]() =
= =0.1molL-1min-1,SO2转化率=
=0.1molL-1min-1,SO2转化率=![]() ×100%=20%,故答案为:0.1molL-1min-1;20%;
×100%=20%,故答案为:0.1molL-1min-1;20%;
(2)A.容器内压强不再发生变化,该反应两边气体体积不相等,反应过程中压强是变量,压强不变,该反应达到了平衡状态,故A正确;B.SO2的体积分数不再发生变化,表明正逆反应速率相等,达到了平衡状态,故B正确;C.容器内气体原子总数不再发生变化,根据原子守恒,原子总数始终不变,所以原子总数不能作为判断平衡状态的依据,故C错误;D.相同时间内消耗2nmolSO2的同时消耗nmolO2,都是指的是正反应方向,因此不能作为判断平衡状态的依据,故D错误;E.相同时间内消耗2nmolSO2的同时生成nmolO2,相同时间内消耗2n mol SO2等效于消耗n mol O2,同时生成n mol O2,正反应速率等于逆反应速率,故E正确;F.容器内气体密度不再发生变化,容器容积不变,气体的总质量不变,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故F错误;故答案:ABE;
(3)A.向容器中通入少量O2,即增大氧气的浓度,反应速率加快,故A正确;B.扩大容器的体积,容器内气体的浓度减小,反应速率减慢,故B错误;C.使用正催化剂,反应速率加快,故C正确;D.升高温度,反应速率加快,故D正确;E.向容器中通入少量氦气,当恒容时,各组分的浓度不变,则反应速率不变,故E错误;故选ACD;
(4)t℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,设二氧化硫和氧气物质的量各为1mol,反应达到化学平衡时,混合气体体积减少了20%,根据2SO2(g)+O2(g) ![]() 2SO3(g),反应的氧气体积为混合气体减小的体积,即反应的氧气的物质的量为混合气体减小的减小的物质的量,为2mol×20%=0.4mol,则反应的二氧化硫为0.8mol,转化率为
2SO3(g),反应的氧气体积为混合气体减小的体积,即反应的氧气的物质的量为混合气体减小的减小的物质的量,为2mol×20%=0.4mol,则反应的二氧化硫为0.8mol,转化率为![]() ×100%=80%,故答案为:80%。
×100%=80%,故答案为:80%。