题目内容
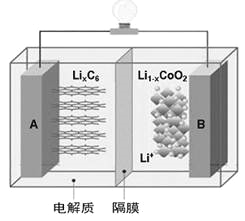
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X处于不同周期,原子的最外层电子数X比Y多一个但比Z少一个,原子的电子层数X比Y、Z少一层。下列说法正确的是
A. 原子半径的大小为:Z>Y>X>W
B. 若Y、Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点:前者低于后者
C. 元素的非金属性:Y>Z
D. 若X的单质为常见的非金属导体,则Y的简单离子能破坏水的电离平衡
【答案】D
【解析】根据题意W是H元素;X、Y、Z在元素周期表的相对位置是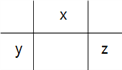 ;原子半径的大小为:Y>Z>X>W,故A错误;若Y、Z的核电荷数之和为X的4倍,则X、Z分别是O、Cl,的气态氢化物的沸点:H2O>HCl,故B错误;同周期元素从左到右非金属性增强,元素的非金属性:Y<Z,故C错误;若X的单质为常见的非金属导体,X是碳元素, Y是Al元素,Al3+水解促进水的电离,故D正确。
;原子半径的大小为:Y>Z>X>W,故A错误;若Y、Z的核电荷数之和为X的4倍,则X、Z分别是O、Cl,的气态氢化物的沸点:H2O>HCl,故B错误;同周期元素从左到右非金属性增强,元素的非金属性:Y<Z,故C错误;若X的单质为常见的非金属导体,X是碳元素, Y是Al元素,Al3+水解促进水的电离,故D正确。
【题型】单选题
【结束】
6
【题目】特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2![]() C6+LiCoO2,下列说法不正确的是
C6+LiCoO2,下列说法不正确的是
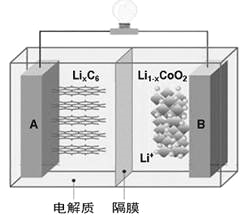
A. 据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边移向右边
B. 放电时,正极锂的化合价未发生改变
C. 废旧钴酸锂电池进行“放电处理”让Li+进入石墨中而有利于回收
D. 充电时阳极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
【答案】C
【解析】电解质是能传导Li+的高分子材料,所以隔膜只允许Li+通过,根据图示,A是负极,放电时Li+从左边移向右边,故A正确;放电时,正极Co元素化合价降低、锂的化合价未发生改变,故B正确;“放电处理”,Li+进入Li1-xCoO2中,故C错误;充电时阳极失电子发生氧化反应,电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+,故D正确。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表;
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______(填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
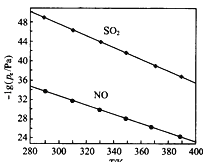
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH(aq)==SO32(aq)+H2O(l)ΔH1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO42(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ ClO(aq)+2OH(aq)===CaSO4(s)+H2O(l)+Cl(aq)的ΔH=______。