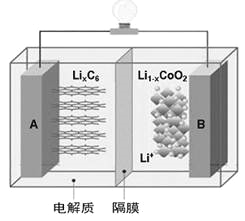
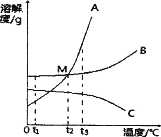
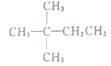
题目内容
【题目】下列除去杂质的实验方法正确的是( )
A.除去CO2中少量O2:用点燃的方法
B.除去NaCl溶液中的Na2SO4:加入适量Ba(NO3)2溶液后,过滤
C.除去Cu中的少量Fe:加入足量稀硫酸溶液后,过滤,洗涤,干燥
D.除去CO2中的少量HCl:通入NaOH溶液后,收集气体
【答案】C
【解析】解:A、氧气不能燃烧,只能支持燃烧,故A错误; B、硫酸钠和硝酸钡反应生成硫酸钡和硝酸钠,故引入了新杂质,故B错误;
C、铜不溶于稀硫酸,故加稀硫酸后,铁与稀硫酸反应生成硫酸亚铁和氢气,然后将铜过滤出,洗涤干燥即可,故C正确;
D、二氧化碳为酸性氧化物,氢氧化钠能和二氧化碳反应,将二氧化碳吸收,故D错误.
故选C.

【题目】某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备氧气,并对氯气的性质进行探究。
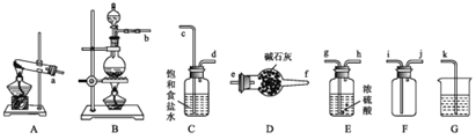
(1)写出实验室制氯气的化学方程式________。欲制取并收集一瓶干燥的氯气,则“制取→收集”的实验装置连接顺序为:____→c→d→_____→i→j→k
(2)装置C中饱和食盐水的作用是______________。
(3)该小组同学对氯气性质进行如下探究:
实验步骤 | 实验结论 |
①将氯气通入到NaCl溶液中,再加入1mL CCl4振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序: 氯、溴、碘 |
②将氯气通入到KBr溶液中,再加入1mL CCl4振荡,静置,观察四氯化碳层颜色 | |
③将氯气通入到KI溶液中,再加入1mL CCl4振荡,静置,观察四氧化碳层颜色 |
该小组的实验设计缺陷是___________,改进的办法是________________。
(4)常温下,高锰酸钾固体和浓盐酸反应也可制得氯气,该反应的离子方程式为______________。
(5)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的质量之比为______________。