题目内容
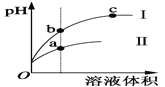
【题目】关于0.1 mol/L醋酸钠溶液,下列说法正确的是
A. 加少量水稀释时,![]() 增大
增大
B. 向其中再加入少量醋酸钠晶体时,溶液中所有离子浓度都增大
C. 离子浓度大小比较:c(CH3COO-) >c(Na+) >c(OH-) > c(H+)
D. 向其中加入盐酸至恰好呈中性时,c(Na+) = c(CH3COO-)
【答案】A
【解析】在醋酸钠溶液中存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-。A项,加水稀释,促进CH3COO-的水解,n(CH3COOH)增大,n(CH3COO-)减小,
CH3COOH+OH-。A项,加水稀释,促进CH3COO-的水解,n(CH3COOH)增大,n(CH3COO-)减小,![]() =
=![]() 增大,正确;B项,再加入少量醋酸钠晶体,c(CH3COO-)增大,水解平衡正向移动,c(OH-)增大,但温度不变水的离子积不变,c(H+)减小,错误;C项,离子浓度由大到小的顺序为c(Na+)
增大,正确;B项,再加入少量醋酸钠晶体,c(CH3COO-)增大,水解平衡正向移动,c(OH-)增大,但温度不变水的离子积不变,c(H+)减小,错误;C项,离子浓度由大到小的顺序为c(Na+)![]() c(CH3COO-)
c(CH3COO-)![]() c(OH-)
c(OH-)![]() c(H+),错误;D项,向溶液中加入HCl,溶液中的电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),溶液呈中性c(H+)=c(OH-),则c(Na+)=c(CH3COO-)+c(Cl-),错误;答案选A。
c(H+),错误;D项,向溶液中加入HCl,溶液中的电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),溶液呈中性c(H+)=c(OH-),则c(Na+)=c(CH3COO-)+c(Cl-),错误;答案选A。

【题目】某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备氧气,并对氯气的性质进行探究。
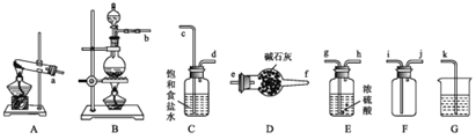
(1)写出实验室制氯气的化学方程式________。欲制取并收集一瓶干燥的氯气,则“制取→收集”的实验装置连接顺序为:____→c→d→_____→i→j→k
(2)装置C中饱和食盐水的作用是______________。
(3)该小组同学对氯气性质进行如下探究:
实验步骤 | 实验结论 |
①将氯气通入到NaCl溶液中,再加入1mL CCl4振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序: 氯、溴、碘 |
②将氯气通入到KBr溶液中,再加入1mL CCl4振荡,静置,观察四氯化碳层颜色 | |
③将氯气通入到KI溶液中,再加入1mL CCl4振荡,静置,观察四氧化碳层颜色 |
该小组的实验设计缺陷是___________,改进的办法是________________。
(4)常温下,高锰酸钾固体和浓盐酸反应也可制得氯气,该反应的离子方程式为______________。
(5)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的质量之比为______________。
【题目】某实验室模拟工业硫化碱法制取硫代硫酸钠(Na2S2O3)并探究其性质。
(1)制取硫代硫酸钠的反应装置及所需试剂如图:
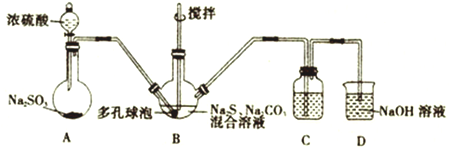
①装置A中发生反应的化学方程式为__________________________。打开分液漏斗的活塞时,发现液体不能顺利滴下,可能的原因是__________________________________。
②装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为______________________________。
③装置C是为了检验装置B中SO2的吸收效率,则C中的试剂为________________,当B中SO2的吸收效率低时,C中的现象为________________________,除搅拌和使用多孔球泡外,再写出一种提高B中SO2的吸收效率的方法:______________________________。
(2)预测并探究硫代硫酸钠的性质(反应均在溶液中进行):
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | _________ | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3 | ______ |
①探究1中的实验操作为________________________。
②探究2中的实验现象为_____________________,反应的离子方程式为_____________。