题目内容
【题目】Ⅰ.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
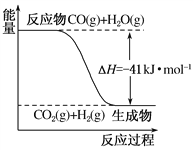
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:该反应的热化学方程式为
________________________________
(2)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1,则C(s)+CO2(g)===2CO(g) ΔH=________。
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g) ΔH=________。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:
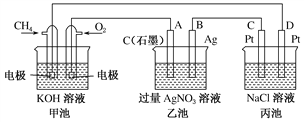
(1)甲池是________装置,乙装置中电极A的名称是____。
(2)甲装置中通入CH4的电极反应式为_______________________,乙装置中电极B(Ag)的电极反应式为_______________________
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式)。
【答案】 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1 +172 kJ·mol-1 -46.2 kJ·mol-1 原电池 阳极 CH4+10OH--8e-===CO![]() +7H2O Ag++e-===Ag 12 HCl
+7H2O Ag++e-===Ag 12 HCl
【解析】Ⅰ.(1)图象分析反应是放热反应,焓变为-41KJ/mol,标注物质狙击状态和对应反应焓变得到热化学方程式为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJmol-1,故答案为:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-41kJmol-1;
(2)①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJmol-1;②C(s)+H2O(g)═CO(g)+H2(g) △H=+131kJmol-1,依据盖斯定律②-①得到:C(s)+CO2(g)═2CO(g)△H═+172kJ/mol,故答案为:+172kJ/mol;
(3)N≡N键的键能是948.9kJmol-1,H-H键的键能是436.0kJmol-1;N-H键的键能是391.55kJmol-1.则![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g);△H=反应物键能总和-生成物键能总和=
H2(g)═NH3(g);△H=反应物键能总和-生成物键能总和=![]() ×948.9kJmol-1 +
×948.9kJmol-1 +![]() ×436.0kJmol-1 -3×391.55kJmol-1=-46.2kJ/mol,故答案为:-46.2kJ/moL;
×436.0kJmol-1 -3×391.55kJmol-1=-46.2kJ/mol,故答案为:-46.2kJ/moL;
Ⅱ.(1)甲池中一极通入甲烷,另一极通入氧气,所以甲池为甲烷形成的燃料电池,通入甲烷的一极为负极,通入氧气的一极为正极,A与正极相连,所以A为阳极;故答案为:原电池;阳极;
(2)CH4在负极上失电子,碱性条件下生成碳酸根,所以甲装置中通入CH4的电极反应式为CH4+10OH--8e-=CO32-+7H2O;乙装置中B(Ag)的电极为银离子得电子,其电极反应式为:Ag++e-=Ag;故答案为:CH4+10OH--8e-=CO32-+7H2O;Ag++e-=Ag;
(3)设电解后氢氧化钠的物质的量浓度是xmol/L,丙池中产生112mL,则氢气的体积与氯气的体积相同均为56mL,
2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH,
H2↑+Cl2↑+2NaOH,
22.4L 2mol
0.056L 0.5xmol
则x=![]() =0.01mol/L,则c(H+)=10-12 mol/L,所以溶液的pH=12,由于电解生成H2和Cl2从溶液中逸出,所以应该加二者的化合物,即加入HCl,故答案为:12;HCl。
=0.01mol/L,则c(H+)=10-12 mol/L,所以溶液的pH=12,由于电解生成H2和Cl2从溶液中逸出,所以应该加二者的化合物,即加入HCl,故答案为:12;HCl。