题目内容
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
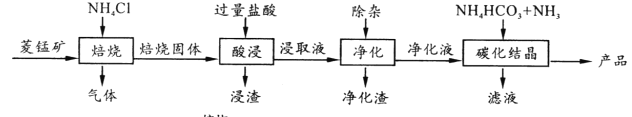
已知:MnCO3+2NH4Cl ![]() MnCl2+CO2↑+2NH3↑+H2O↑
MnCl2+CO2↑+2NH3↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
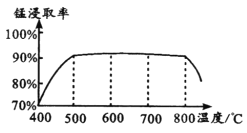
焙烧时适宜温度为_____;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160g于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH溶液至碱性,发生反应2Mn2++O2+4OH-=2MnO(OH)2;
II 加入过量KI溶液和适量稀H2SO4,发生反应:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
【答案】 500℃ 温度过高,NH4Cl分解导致与MnCO3的反应不彻底,使浸取率减小(或MnCO3分解发生其它副反应,使浸取率减小或MnCl2挥发导致Mn损失或高温下锰被氧化成高价态造成浸取率低或高温固体烧结,固体表面积减少等) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Fe(OH)3、Al(OH)3 Mn2++HCO3-+NH3==MnCO3↓+NH4+ 滴入最后一滴Na2S2O3溶液,溶液蓝色褪去且半分钟内颜色不复原 99.14%
【解析】(1)由图示得到,500℃的时候,锰的浸取率已经很大,所以选取500℃即可,没有必要选择更高的温度(因为温度越高,能耗越大)。温度很高时,浸取率下降,有可能是高温下氯化铵分解使反应的量减少(不是很好的答案,因为氯化铵分解的温度大约为337℃);可能是生成的氯化锰转化为气体离开体系(也不是很好,氯化锰沸点为1190℃);可能是高温下发生副反应,锰转化为其他化合物。
(2)①加入二氧化锰的目的是为了将Fe2+氧化为Fe3+,所以方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。
②物质中的杂质主要是Fe、Ca、Mg、Al等元素,因为步骤③中除去Ca2+、Mg2+,所以步骤②加氨水调pH,是为了除去Fe和Al元素,所以沉淀主要是Fe(OH)3、Al(OH)3。
(3)碳化结晶是向氯化锰溶液中加入碳酸氢铵和氨水,得到碳酸锰的固体,所以方程式为:Mn2++HCO3-+NH3==MnCO3↓+NH4+。
(4)①取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,此时溶液显蓝色,用硫代硫酸钠滴定单质碘,终点时,因为碘单质都被反应,所以溶液褪为无色,所以终点的现象为:滴入最后一滴Na2S2O3溶液,溶液蓝色褪去且半分钟内颜色不复原。
②根据滴定中的反应得到关系式:2Mn2+~2MnO(OH)2~2I2~4S2O32-。滴加的硫代硫酸钠为20×0.1÷1000=0.002mol,根据关系式Mn2+为0.001mol,因为是取1/10进行的滴定,所以Mn2+为0.01mol,所以氯化锰也是0.01mol,质量为115×0.01=1.15g,质量分数为1.15÷1.16=99.14%。

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大
A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
C | 与B同主族 |
D | 前四周期中金属性最强的元素 |
E | 前四周期中原子核外孤电子数最多 |
(1)C元素位于第__________________周期__________________族,B元素的核外电子排布式为__________________,E元素的价电子排布图为__________________。
(2)B、C两元素的电负性大小关系为:__________________(用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:________________(用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有__________________。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是__________________。
(5)D2B2的电子式为__________________,与CO2反应生成B的单质的化学方程式为:__________________。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:__________________