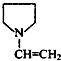
题目内容
18.在Na2SO3中硫元素的化合价为+4价,因此Na2SO3在一定条件下既可表现氧化性,又可表现还原性.现有试剂:溴水,Na2S溶液,Na2SO3溶液,稀硫酸,氨水,NaOH溶液.(1)要证明Na2SO3具有还原性,应选用的试剂是Na2SO3溶液、溴水,其反应的离子方程式为Br2+SO32-+H2O=SO42-+2Br-+2H+.
(2)要证明Na2SO3具有氧化性,应选用的试剂为稀H2SO4和Na2S溶液,实验中有黄色沉淀生成,则反应的离子方程式为SO32-+2S2-+6H+=3S+3H2O.
(3)要证明H2SO3酸性弱于H2SO4,应选用的试剂是稀H2SO4,其反应的离子方程式为SO32-+2H+=H2O+SO2↑.
分析 (1)要证明Na2SO3具有还原性,题中只有溴水具有强氧化性,可与亚硫酸钠发生氧化还原反应;
(2)要证明Na2SO3具有氧化性,题中具有强还原性的只有Na2S溶液,可在酸性条件下与亚硫酸钠发生氧化还原反应;
(3)要证明H2SO3酸性弱于H2SO4,利用强酸制弱酸原理分析.
解答 解:(1)要证明Na2SO3具有还原性,题中只有溴水具有强氧化性,则选择的试剂为Na2SO3溶液、溴水,二者发生氧化还原反应,可观察到溴水褪色,反应的离子方程式为Br2+SO32-+H2O=2Br-+SO42-+2H+,
故答案为:Na2SO3溶液、溴水;Br2+SO32-+H2O=2Br-+SO42-+2H+;
(2)要证明Na2SO3具有氧化性,具有强还原性的只有Na2S溶液,可在酸性条件下与亚硫酸钠发生氧化还原反应,反应的离子方程式为SO32-+2S2-+6H+=3S↓+3H2O,
可观察到溶液变浑浊,
故答案为:SO32-+2S2-+6H+=3S↓+3H2O;
(3)要证明H2SO3酸性弱于H2SO4,利用强酸制弱酸原理:稀硫酸与Na2SO3溶液生成二氧化硫,其反应的方程式为:SO32-+2H+=H2O+SO2↑;
故答案为:稀H2SO4;SO32-+2H+=H2O+SO2↑.
点评 本题考查氧化还原反应知识,侧重于学生的分析能力和元素化合物知识的综合运用,注意把握常见含硫化合物的性质,难度不大.

练习册系列答案
相关题目
8.下列说法错误的是( )
| A. | 实验室制取蒸馏水和用海水晒盐都利用了相同的物质分离方法 | |
| B. | 往盛有少量淀粉溶液的试管中加入一定量稀硫酸,加热3~4分钟后,再加入NaOH溶液至碱性,最后加入银氨溶液并水浴加热,有“银镜”出现 | |
| C. | 受强碱腐蚀致伤时,应先用大量水冲洗,再用2%的醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 | |
| D. | 采用比色的方法测定溶液颜色的深浅,根据溶液颜色与反应物浓度的关系,可换算成反应物在不同反应时刻的浓度 |
9.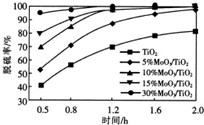 用TiO2负载MoO3催化剂使有机物R催化脱硫,负载MoO3的量对反应脱硫率的影响如图.下列说法正确的是( )
用TiO2负载MoO3催化剂使有机物R催化脱硫,负载MoO3的量对反应脱硫率的影响如图.下列说法正确的是( )
 用TiO2负载MoO3催化剂使有机物R催化脱硫,负载MoO3的量对反应脱硫率的影响如图.下列说法正确的是( )
用TiO2负载MoO3催化剂使有机物R催化脱硫,负载MoO3的量对反应脱硫率的影响如图.下列说法正确的是( )| A. | 负载MoO3的量越大,平衡常数越大 | |
| B. | 当反应时间小于0.5h,脱硫率为0 | |
| C. | 1.6h负载MoO3的量为10%和15%的脱硫率相等 | |
| D. | 0.5~1.2h时,负载MoO3的量越大,脱硫速率越大 |
6.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
| A. | 再通入少量氯气,$\frac{C({H}^{+})}{C(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量固体NaOH,溶液呈中性时,c(Na+)=c(Cl-)+c(ClO-) | |
| D. | 加入少量水,水的电离平衡向正反应方向移动 |
13.下列解释实验事实的反应方程式不正确的是( )
| A. | 盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗 4 Na+O2=2Na2O | |
| C. | 燃煤中加入石灰石可以减少SO2的排放:O2+2CaCO3+2SO2=2CO2+2CaSO4 | |
| D. | 酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
3.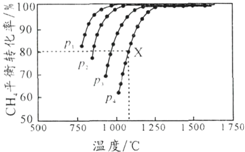 向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
 向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )| A. | 平衡时CO与H2的物质的量比为1:1 | |
| B. | p1、p2、p3、p4由小到大的顺序为p1<p2<p3<p4 | |
| C. | 1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2)=0.008 mol•L-1•min-1 | |
| D. | 随着温度升高,该反应的平衡常数减小 |
10.某元素质量数51,中子数28,其基态原子未成对电子数为( )
| A. | 4 | B. | 1 | C. | 2 | D. | 3 |
7.下列关于可逆反应的叙述不正确的是( )
| A. | 某可逆反应达平衡状态时反应物和生成物共存 | |
| B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2与2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O互为可逆反应 | |
| C. | 对于可逆反应,加入催化剂可使正逆反应速率均增大 | |
| D. | 提高可逆反应的限度可增加产量,从而提高经济效益 |
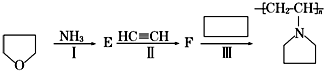
 ,F
,F