题目内容
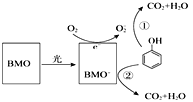
【题目】电解100mL含c(H+)=0.3mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A. 0.10mol/LAg+B. 0.20mol/LZn2+C. 0.20mol/LCu2+D. 0.20mol/LPb2+
【答案】C
【解析】
Zn2+和Pb2+的放电顺序都在H+后面,所以含有这两种阳离子的盐溶液中,阴极上放出H2,无金属析出,而含有银离子和铜离子这两种阳离子的盐溶液中,金属Ag和Cu先在阴极析出;
A.0.10mol/LAg+在氢离子之前放电,Ag+物质的量为0.01mol,电路中通过0.04mol电子时Ag+已经全部放电,金属银的质量是 0.1molmol/L×0.1L×108g/mol=1.08g;
B.Zn2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属;
C.铜离子先放电,100mL0.20mol/L溶液中Cu2+物质的量为0.02mol,电路中通过0.04mol电子时Cu2+完全放电,所以析出金属铜的质量为:![]() ×0.04mol×64g/mol=1.28g;
×0.04mol×64g/mol=1.28g;
D.Pb2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属;
所以析出金属质量最大的是0.20mol/LCu2+,故答案为C。

【题目】NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如图:
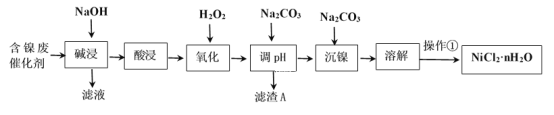
部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
(1)Al的原子结构示意图为___。
(2)“酸浸”、“溶解”所使用的酸为___。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、____。
(3)“氧化”加入H2O2溶液,其作用是___(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为____。
(4)“操作①”的实验操作依次为缓缓加热,浓缩至___为止、冷却结晶、过滤、洗涤、干燥,即得产品。
(5)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___。