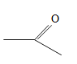
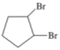
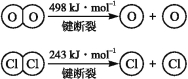
题目内容
【题目】A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E(双核18电子离子)的电子数少8。
①A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,乙与甲的水溶液反应的离子方程式为__________;
②B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,该反应的化学方程式为_____________;
③H2、O2和甲的水溶液可形成氢氧燃料电池,负极的电极反应为:___________;
④有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子数相同,是火箭发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_______,1mol戊与过量盐酸反应的离子方程式是___________。
【答案】![]()
![]()
![]()
![]()
【解析】
A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E(双核18电子离子)的电子数少8,E为双核18电子离子,则A、B、C、D为10电子的离子。常见的短周期元素形成的10电子离子是Ne原子的前后非金属形成的阴离子以及第三周期的金属形成的阳离子,
①A与B结合成的化合物甲中既有离子键又有共价键,且甲可溶于水,符合的物质为NaOH;A与C结合成乙难溶于水,则A为氢氧根离子,B为钠离子,C可能是镁离子或者铝离子,又因难溶物乙溶于甲的水溶液得无色透明溶液,则乙只能是氢氧化铝,C为铝离子,乙与甲的水溶液反应离子方程式:![]() ,故答案为:
,故答案为:![]() ;
;
②B与E结合成化合物丙,其中离子数之比为2∶1,B为钠离子,E为过氧根离子,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,则丁为H2O,D为![]() ,丁与丙反应为
,丁与丙反应为![]() ,故答案为:
,故答案为:![]() ;
;
③H2、O2和氢氧化钠的水溶液可形成氢氧燃料电池,负极的电极反应为![]() ,故答案为:
,故答案为:![]() ;
;
④有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,则氮氢的个数比=![]() ,与E的电子数相同,即含18电子,则戊为N2H4,结构式为
,与E的电子数相同,即含18电子,则戊为N2H4,结构式为 ,1mol戊与过量盐酸反应类似于氨气与酸的反应,反应方程式为
,1mol戊与过量盐酸反应类似于氨气与酸的反应,反应方程式为![]() ,故答案为:
,故答案为: ;
;![]() 。
。
一核:Ne、N3-、O2-、F-、Na+、Mg2+、Al3+ | 二核:HF、OH- | ||
三核:H2O、NH2- | 四核:NH3、H3O+ | ||
五核:CH4 | |||
一核:Ar、K+、Ca2+、Cl-、S2- | 二核:F2、HCl、HS- | ||
三核:H2S | 四核:PH3、H2O2 | ||
五核:SiH4 CH3F | 六核:N2H4 CH3OH | ||

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是__________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________(填一种方法即可)。
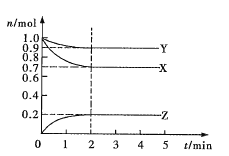
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
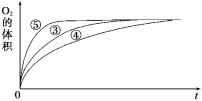
分析该图能够得出的实验结论是___________。
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同的方式投入反应物,发生反应 N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
容器甲 | 容器乙 | 容器丙 | |
反应温度/℃ | 400 | 400 | 500 |
反应物投入量 | 1molN2,3molH2 | 4molNH3 | 1molN2,3molH2 |
平衡时v(正)(H2)/mol/(Ls) | v1 | v2 | v3 |
平衡时c(NH3)/(mol/L) | c1 | c2 | c3 |
平衡时总压强P/Pa | P1 | P2 | P3 |
物质的平衡转化率a | a1(N2) | a2(NH3) | a3(N2) |
平衡常数K | K1 | K2 | K3 |
下列关系正确的是
A. v1<v2,c1<2c2 B. c2>2c3,a2(NH3)+a3(N2)<1
C. K1>K3, P2>2P3 D. v1<v3,a1(N2)<a3(N2)