题目内容
11.锌-溴蓄电池的充、放电的电池总反应为Zn+Br2$?_{充电}^{放电}$Zn2++2Br-,下列各反应:①Zn-2e-=Zn2+;②Br2+2e-=2Br-;③2Br--2e-=Br2;④Zn2++2e-=Zn,其中充电的阳极和放电的负极的反应分别是( )| A. | ①② | B. | ③② | C. | ④② | D. | ③① |
分析 充电时,该装置是电解池,阳极上失电子发生氧化反应;放电时,该装置是原电池,负极上失电子发生氧化反应,据此分析.
解答 解:充电时,该装置是电解池,阳极上溴离子失电子生成溴单质而发生氧化反应,即2Br--2e-═Br2;放电时,该装置是原电池,负极上锌失电子生成锌离子而发生氧化反应,即Zn-2e-═Zn2+,故选D.
点评 本题考查了原电池原理和电解池原理,侧重于电极方程式的书写的考查,题目难度不大,注意把握阴阳极和正负极上的反应物质及得失电子.

练习册系列答案
相关题目
1.下列变化不能通过一步直接完成的是( )
| A. | SO2→H2SO4 | B. | Al(OH)3→Al2O3 | C. | SiO2→H2SiO3 | D. | Fe(OH)2→Fe(OH)3 |
2.在冷暗条件下就能跟H2发生剧烈反应而爆炸的物质是( )
| A. | N2 | B. | F2 | C. | O2 | D. | C12 |
19.下列变化中,属于化学变化的是( )
| A. | 石油分馏 | |
| B. | 煤的干馏 | |
| C. | 苯中加入溴水 | |
| D. | 煤焦油中提取苯、甲苯、二甲苯等产物 |
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 断裂旧化学键吸收的总能量小于形成新化学键放出的总能量 |
16.下列叙述中,正确的是( )
| A. | 乙醛与银氨溶液水浴共热,发生还原反应得到光亮如镜的银 | |
| B. | 苯乙烯与氢气在合适条件下,发生加成反应生成乙基环己烷 | |
| C. | 乙醇与浓硫酸共热迅速升温至140℃时,发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下,发生取代反应主要生成2,4二氯甲苯 |
3.1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4═Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C═Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3═Na2CO3+CaS
下列说法正确的是( )
①用NaCl与H2SO4反应制Na2SO4:2NaCl+H2SO4═Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:Na2SO4+4C═Na2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:Na2S+CaCO3═Na2CO3+CaS
下列说法正确的是( )
| A. | ②③两步都是氧化还原反应 | B. | 只有第②步是氧化还原反应 | ||
| C. | 该方法对生产设备基本没有腐蚀 | D. | 该方法对环境污染较小 |
20.下列有关化学用语正确的是( )
| A. | 26Fe的价层电子排布式为3d64s2 | |
| B. | 35Br的电子排布式可简写为[Ar]4s24p5 | |
| C. | NH4Cl的电子式为 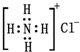 | |
| D. | 氯离子结构示意图为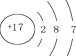 |
15.W、X、Y、Z、M、Q均为除稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的4倍,Z与M的最低负化合价相同,X、M在周期表中位置如图所示.
(1)W2与Z2反应化合物甲,W2与Q2反应生成化合物乙.已知反应:
乙(g)+Z2(g)→甲(g)+Q2(g),每生成1mol Q2放热57.8kJ.写出该反应的热化学方程式:2HCl(g)+$\frac{1}{2}$O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol或4HCl(g)+O2(g)=2H2O(g) 2Cl2(g)△H=-115.6 kJ/mol;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式说明)NH4++H2O?NH3.H2O+H+;该溶液中各种离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(3)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:
2CO+2NO N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
(4)将1mol丙气体和1mol丁气体充入装有催化剂的恒压容器中,充分反应达平衡后:①若气体体积较原来减少23%,则丁的转化率为92%;
②已知该反应△H<0,则升高温度,平衡常数K值将变小(填变大、变小或不变);
③若仅将压强增大为原来的2倍,再次达平衡后,混合气体中丁的体积分数将变小(填变大、变小或不变).
(5)由X的最简单气态氢化物、Z的单质和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为CH4+10OH--8e-=CO32-+7H2O.
| X | ||
| M |
乙(g)+Z2(g)→甲(g)+Q2(g),每生成1mol Q2放热57.8kJ.写出该反应的热化学方程式:2HCl(g)+$\frac{1}{2}$O2(g)=H2O(g)+Cl2(g)△H=-57.8 kJ/mol或4HCl(g)+O2(g)=2H2O(g) 2Cl2(g)△H=-115.6 kJ/mol;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式说明)NH4++H2O?NH3.H2O+H+;该溶液中各种离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(3)X、Y可分别与Z以原子个数比1:1形成化合物丙和丁.在催化剂存在条件下,丙与丁发生可逆反应,生成单质Y2和另一种化合物戊.写出该反应的化学方程式:
2CO+2NO
 N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;
N2+2CO2,该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({N}_{2})}{{c}^{2}(CO)•{c}^{2}(NO)}$;(4)将1mol丙气体和1mol丁气体充入装有催化剂的恒压容器中,充分反应达平衡后:①若气体体积较原来减少23%,则丁的转化率为92%;
②已知该反应△H<0,则升高温度,平衡常数K值将变小(填变大、变小或不变);
③若仅将压强增大为原来的2倍,再次达平衡后,混合气体中丁的体积分数将变小(填变大、变小或不变).
(5)由X的最简单气态氢化物、Z的单质和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为CH4+10OH--8e-=CO32-+7H2O.