题目内容
16.下列关于物质用途的说法正确的是( )| A. | SO2可用来漂白馒头、银耳等食品 | |
| B. | 纯净的二氧化硅是制备光导纤维的原料 | |
| C. | 氢氧化铝可以用做耐火材料 | |
| D. | 四氧化三铁常用作红色油漆和涂料 |
分析 A.二氧化硫有毒,不能漂白食品;
B.光导纤维的主要材料是二氧化硅,是利用光的全反射原理;
C.氢氧化铝易分解生成氧化铝,氧化铝熔点较高;
D.四氧化三铁是黑色固体,俗称磁性铁.
解答 解:A.二氧化硫有毒,不能漂白食品,否则易损坏人的消耗器官,对人体造成伤害,故A不选;
B.光导纤维的主要材料是二氧化硅,是利用光的全反射原理,所以可以用二氧化硅制取光导纤维,故B选;
C.氢氧化铝易分解生成氧化铝,氧化铝熔点较高,一般条件下不易熔融,所以可以用氧化铝做耐火材料,故C不选;
D.四氧化三铁是黑色固体,俗称磁性铁,氧化铁是红棕色固体,可以用于做红色油漆和涂料,故D不选;
故选B.
点评 本题考查物质的用途,侧重考查元素化合物知识,明确物质的性质是解本题关键,性质决定用途,注意二氧化硫漂白性和次氯酸漂白性区别,熟悉常见元素化合物知识,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.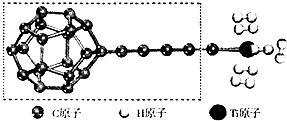 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
M是Mg(填元素符号).
(3)某种新型储氧材料的理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型有3种.
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心.由钾、镁、氟形成的该化合物的化学式为KMgF3,每个K+与12个F-配位.
 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)某种新型储氧材料的理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型有3种.
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心.由钾、镁、氟形成的该化合物的化学式为KMgF3,每个K+与12个F-配位.
7.下列说法不正确的是( )
| A. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c (Na+)=c(CH3COO-)+c(CH3COOH) | |
| B. | 将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后,溶液中粒子的物质的量浓度大小关系为:c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 将纯水加热至较高温度,水的离子积变大,pH变大,呈中性 | |
| D. | 将稀氨水加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$ 增大 |
4.奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运会更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关.下列说法中正确的是( )
| A. | 焰色反应均应透过蓝色钴玻璃观察 | |
| B. | NaC1与Na2CO3灼烧时火焰颜色相同 | |
| C. | 焰色反应是化学变化 | |
| D. | 所有金属及其化合物灼烧时火焰均有颜色 |
1.下列变化不能通过一步直接完成的是( )
| A. | SO2→H2SO4 | B. | Al(OH)3→Al2O3 | C. | SiO2→H2SiO3 | D. | Fe(OH)2→Fe(OH)3 |
8.下列说法中正确的是( )
| A. | 两个原子或多个原子之间的相互作用叫化学键 | |
| B. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 只有金属元素和非金属元素化合时才能形成离子键 | |
| D. | 离子化合物中一定含有离子键 |
5.以氯乙烷为原料制取乙二醇,需要经过的反应为( )
| A. | 加成-消去-水解 | B. | 消去-水解-加成 | C. | 消去-加成-水解 | D. | 取代-消去-加成 |
6.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 断裂旧化学键吸收的总能量小于形成新化学键放出的总能量 |