题目内容
9.用如图所示的实验装置完成对应的实验(部分仪器已省略),不能达到实验目的是( )| A. |  制取纯净氢氧化亚铁 | B. | 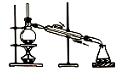 石油的蒸馏 | ||
| C. | 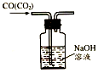 除去CO气体中的CO2气体 | D. | 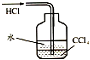 吸收HCl |
分析 A.氢氧化亚铁不稳定,易被氧气氧化生成氢氧化铁,所以制取氢氧化亚铁需要隔绝空气;
B.石油蒸馏时温度计测量馏分温度,且冷凝管中的水遵循“下进上出”原则;
C.二氧化碳易溶于NaOH溶液而CO不易溶于氢氧化钠溶液;
D.有缓冲装置的能防止倒吸.
解答 解:A.氢氧化亚铁不稳定,易被氧气氧化生成氢氧化铁,所以制取氢氧化亚铁需要隔绝空气,所以制备氢氧化亚铁时滴管应该伸入液面下,故A错误;
B.根据沸点不同将石油分馏,所以石油蒸馏时温度计测量馏分温度,且冷凝管中的水遵循“下进上出”原则,否则易炸裂冷凝管,故B正确;
C.二氧化碳易溶于NaOH溶液而CO不易溶于氢氧化钠溶液,所以可以采用NaOH溶液洗气,故C正确;
D.有缓冲装置的能防止倒吸,HCl极易溶于水不易溶于四氯化碳,所以该装置有缓冲作用,能防止倒吸,故D正确;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及除杂、尾气处理、物质制备等实验基本操作,明确实验原理是解本题关键,注意B中温度计位置、常见防止倒吸装置,题目难度不大.

练习册系列答案
相关题目
15.下列实验操作、现象和结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向FeSO4溶液中滴入少量酸性KMnO4溶液 | KMnO4溶液紫色褪去 | Fe2+有氧化性 |
| B | 向Na2SiO3溶液中通入适量的CO2 | 产生白色胶状物质 | 酸性:H2CO3>H2SiO3 |
| C | 将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液呈橙红色 | 氧化性:Cl2>Br2 |
| D | 向Al2(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al3+与NH3•H2O不能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
20.化学与日常生活密切相关,下列有关说法错误的是( )
| A. | 使用LED照明灯属于“低碳生活”方式 | |
| B. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被侵蚀 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl,Na2CO3) | |
| D. | 研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生 |
17.工业上获得大量乙烯、丙烯、丁二烯的方法是( )
| A. | 卤代烃消除 | B. | 煤高温干馏 | C. | 炔烃加成 | D. | 石油裂解 |
4.氰氨化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN→CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )
| A. | CO为氧化产物,H2为还原产物 | B. | CaCN2含有共价键,属于共价化合物 | ||
| C. | HCN既是氧化剂又是还原剂 | D. | 每消耗10g CaCO3生成2.24L CO2 |
14.如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
(1)③、④、⑦的原子半径由大到小的顺序为Na>Cl>F (用元素符号表示).
(2)⑥和⑦的最高价含氧酸的酸性强弱为HClO4>H2SO4 (用酸的化学式表示).
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe 2+氧化,写出该反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.

①写出D溶液与G反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②写出检验A溶液中溶质的阴离子的方法取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成.
③常温下,若电解1L0.1mol•L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为0.01mol.
④写出过量的E与F溶液中溶质反应的离子方程式AlO2-+4H+=Al3++2H2O.
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(2)⑥和⑦的最高价含氧酸的酸性强弱为HClO4>H2SO4 (用酸的化学式表示).
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe 2+氧化,写出该反应的离子方程式H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性.

①写出D溶液与G反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②写出检验A溶液中溶质的阴离子的方法取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成.
③常温下,若电解1L0.1mol•L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为0.01mol.
④写出过量的E与F溶液中溶质反应的离子方程式AlO2-+4H+=Al3++2H2O.
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
1.某一不饱和酯类化合物(如图)在药物、涂料等领域应用广泛,下列有关说法不正确的是( )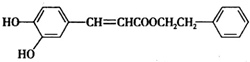
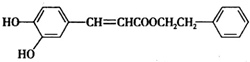
| A. | 能使KMnO4溶液褪色 | |
| B. | 1mol的该化合物和足量的钠反应生成1molH2 | |
| C. | 能与溴发生取代反应和加成反应 | |
| D. | 1mol该化合物最多与2molNaOH反应 |
18.在对电子运动状态的描述中,确定一个“轨道”的方面包括( )
①电子层 ②电子亚层 ③电子云的伸展方向 ④电子的自旋状态.
①电子层 ②电子亚层 ③电子云的伸展方向 ④电子的自旋状态.
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ① |
11.将23g钠溶于77g水中,所得溶液中溶质的质量分数为( )
| A. | 等于23% | B. | 大于23% | C. | 等于40% | D. | 大于40% |