题目内容
4.氰氨化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN→CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )| A. | CO为氧化产物,H2为还原产物 | B. | CaCN2含有共价键,属于共价化合物 | ||
| C. | HCN既是氧化剂又是还原剂 | D. | 每消耗10g CaCO3生成2.24L CO2 |
分析 在CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑反应中,HCN中的碳元素化合价由+2升高到+4,对应的氧化产物为CaCN2,HCN中的氢元素化合价由+1价降低到0,对应的还原产物为H2,以此解答该题.
解答 解:A.CO由HCN生成,既不是氧化产物也不是还原产物,故A错误;
B.CaCN2中存在[N=C=N]2-,含有离子键和共价键,属于离子化合物,故B错误;
C.因HCN中的碳元素化合价升高,氢元素的化合价降低,则HCN既是氧化剂又是还原剂,故C正确;
D.气体存在的条件未知,不能确定体积大小,故D错误.
故选C.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意利用元素的化合价来分析氧化还原反应,明确反应中各物质中的元素的化合价是解答的关键,本题的难点是氧化产物的分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列有关实验操作、现象和解释或结论都正确的是( )
| 实验操作 | 现象 | 解释或结论 |
| 在稀硝酸中加入过量的铁粉,充分反应后滴入KSCN溶液 | 溶液呈红色 | HNO3将Fe氧化为Fe3+ |
| AgI沉淀中滴入KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
15.下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
| A. | C5H10和C6H6 | B. | C2H6和C2H4O2 | C. | C3H6和C3H8 | D. | C2H6和C3H8 |
19.一定条件下,CO2分子晶体可转化为具有类似SiO2结构的原子晶体.从理论上分析,下列说法正确的是( )
| A. | 该转化过程是物理变化 | |
| B. | 1molCO2原子晶体中含2molC-O键 | |
| C. | CO2原子晶体的熔点高于SiO2 | |
| D. | CO2的原子晶体和分子晶体互为同分异构体 |
9.用如图所示的实验装置完成对应的实验(部分仪器已省略),不能达到实验目的是( )
| A. |  制取纯净氢氧化亚铁 | B. | 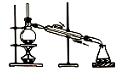 石油的蒸馏 | ||
| C. | 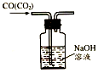 除去CO气体中的CO2气体 | D. | 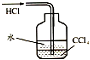 吸收HCl |
16.聚苯乙烯塑料在生产、生活中有广泛应用,其单体苯乙烯可由乙苯和二氧化碳在一定条件下发生如下反应制取:下列有关苯乙烯的说法正确的是( )
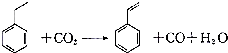

| A. | 分子中含有5个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
13.已知:甲$→_{石墨电极}^{电解}$乙$\stackrel{H_{2}}{→}$丙,若丙的水溶液显酸性,则甲可能为( )
| A. | NaCl | B. | KOH | C. | Al2O3 | D. | MgSO4溶液 |
 A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.
A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.