题目内容
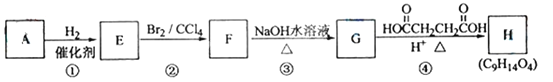
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图。
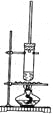
下列对该实验的描述错误的是
A.不能用水浴加热
B.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
C.长玻璃管起冷凝回流作用
D.加入过量乙酸可以提高1-丁醇的转化率
【答案】B
【解析】
A. 实验室制取乙酸丁酯,需要反应温度为115~125℃,而水浴加热适合温度低于100℃的反应,故A正确;
B. 提纯乙酸丁酯需使用碳酸钠溶液,吸收未反应的乙酸,溶解丁醇,降低乙酸丁酯的溶解度,如果用氢氧化钠,会使乙酸丁酯水解,故B错误;
C. 实验室制取乙酸丁酯,原料乙酸和丁醇易挥发,当有易挥发的液体反应物时,为了避免反应物损耗和充分利用原料,要在发生装置设计冷凝回流装置,使该物质通过冷凝后由气态恢复为液态,从而回流并收集,实验室可通过在发生装置安装长玻璃管或冷凝回流管等实现,故C正确;
D.酯化反应为可逆反应,增加乙酸的量,可使平衡向生成酯的方向移动,从而提高1-丁醇的转化率,故D正确;
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
t/s | 0 | 60 | 150 | 250 | 350 | 450 |
n(PCl3)/mol | 0 | 0.12 | 0.19 | 0.2 | 0.2 | x |
请回答下列问题:
(1)x的值是___。
(2)0~60s内,用PCl3的浓度变化表示的化学反应速率是__。
(3)60s时,PCl5的转化率是__。
(4)达平衡时,容器中Cl2的体积分数是__(结果保留一位小数),由表中数据计算此条件下,该反应的平衡常数是__mol·L-1。
【题目】(1)室温下,在0.5mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·(OH-)___(填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4) =1.0×10-12,向0.2mol/L的AgNO3溶液中加入等体积的0.008mol/LK2CrO4溶液, 则溶液中的c(CrO42-)=___。
(3)室温下,0.1mol/LNaHCO3溶液的pH值___0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=")。
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
已知:
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe.则该电池在充电时,阳极发生反应的物质是___,放电时负极反应式为___。