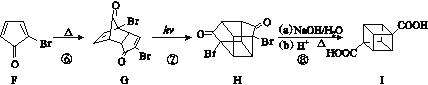
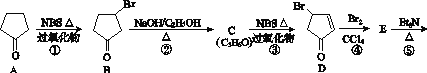题目内容
【题目】(1)室温下,在0.5mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·(OH-)___(填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4) =1.0×10-12,向0.2mol/L的AgNO3溶液中加入等体积的0.008mol/LK2CrO4溶液, 则溶液中的c(CrO42-)=___。
(3)室温下,0.1mol/LNaHCO3溶液的pH值___0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=")。
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
已知:
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe.则该电池在充电时,阳极发生反应的物质是___,放电时负极反应式为___。
【答案】变小 1.19×10-10 mol/L < Na2S,Fe Na-e-=Na+
【解析】
(1)主要考虑纯碱溶液中加入少量水后,由水电离出的c (OH-)变小,据此回答;
(2)溶液混合,发生反应2Ag++CrO4 2-=Ag2CrO4,求出剩余的银离子浓度,再通过Ksp(Ag2CrO4) =1.0×10-12,按公式计算c(CrO42-)=![]() ;
;
(3)要判断室温下0.1mol/LNaHCO3溶液和0.1mol/LNa2SO3溶液的pH值大小,就是先要判断碳酸氢钠溶液是呈碱性的,再要判断![]() 和
和![]() 的水解能力,水解能力大,溶液碱性相对较强;
的水解能力,水解能力大,溶液碱性相对较强;
(4)充电时阳极反应是放电时正极反应的逆反应,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,可据此找到充电时,阳极发生反应的物质,要写放电时负极反应式,可按Na+总量不变找到负极的氧化反应就是钠失去电子的反应;
(1)室温下,在0.5mol/L的纯碱溶液中加入少量水,促进碳酸钠水解,![]() 增加,但是由于加水溶液被稀释,由水电离出的c (OH-)变小,因为由水电离出的c(H+)与c(OH-)相等,所以由水电离出来的c(H+)·c(OH-)变小;
增加,但是由于加水溶液被稀释,由水电离出的c (OH-)变小,因为由水电离出的c(H+)与c(OH-)相等,所以由水电离出来的c(H+)·c(OH-)变小;
答案为:变小;
(2)设两溶液体积均为V,0.2mol/L的AgNO3溶液与等体积的0.008mol/LK2CrO4溶液混合以后,发生反应2Ag++CrO4 2-=Ag2CrO4,反应后n(Ag+)=(0.2mol/L·V-2×0.008mol/L·V)=0.184 mol/L·V,则反应后多余的银离子浓度为c(Ag+)=![]() ,已知Ksp(Ag2CrO4) =1.0×10-12,则c(CrO42-)=
,已知Ksp(Ag2CrO4) =1.0×10-12,则c(CrO42-)=![]() mol/L=1.19×10-10 mol/L;
mol/L=1.19×10-10 mol/L;
答案为:1.19×10-10 mol/L;
(3)![]() 水解反应方程式为:
水解反应方程式为:![]() ,
,![]() 的水解常数为
的水解常数为![]() ,则
,则![]() >5.6×10-11,所以
>5.6×10-11,所以![]() 的水解程度大于其电离程度,碳酸氢钠溶液呈碱性,因为K1(H2CO3)>K2(H2SO3),则
的水解程度大于其电离程度,碳酸氢钠溶液呈碱性,因为K1(H2CO3)>K2(H2SO3),则![]() 的水解能力小于
的水解能力小于![]() 的水解能力,
的水解能力,![]() 溶液的碱性小于
溶液的碱性小于![]() 的溶液的碱性;
的溶液的碱性;
答案为: <;
(4)因为是可充电电池Na—Al/FeS,充电时阳极反应是放电时正极反应的逆反应,因为正极反应式为2Na++FeS+2e-=Na2S+Fe,所以该电池在充电时,阳极反应为Na2S+Fe-2e-=2Na++FeS,则发生反应的物质为Na2S,Fe;
答案为:Na2S,Fe;
因为电池工作时Na+的物质的量保持不变,原电池工作时正极为正极反应式为2Na++FeS+2e-=Na2S+Fe,并且是用含Na+的导电固体作为电解质,可知负极反应为Na-e-=Na+;
答案为:Na-e-=Na+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过如图所示的流程由甲苯氧化制备苯甲醛。
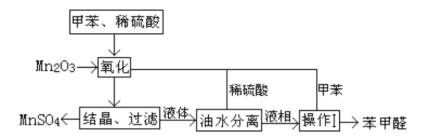
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是___。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的___。
(3)实验过程中,可循环使用的物质分别为___,___。
(4)实验中分离甲苯和苯甲醛采用的操作I是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表),
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___。
【题目】海水是一种丰富的资源,工业生产可以从海水中提取许多有用的物质,这些物质广泛应用于生活、生产、科技等方面。下图是从含碘CCl4溶液得到碘的实验过程:
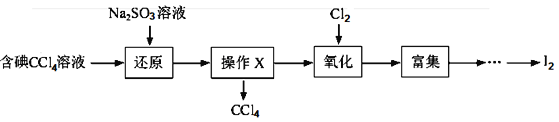
完成下列填空:
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为_________;该操作将I2还原为I-的目的是__________。
(2)操作X的名称为_______,所用的主要仪器是_________。
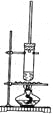
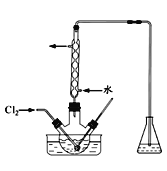
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是_________;锥形瓶里盛放的溶液为________。
(4)已知:5SO32-+2IO3-+2H+ → I2+5SO42-+H2O某含碘溶液(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘溶液中是否同时含有I-、IO3-的实验方案:_______。实验中可供选择的试剂:CCl4、稀盐酸、淀粉溶液
(5)浓海水提取镁的工艺流程如下图:
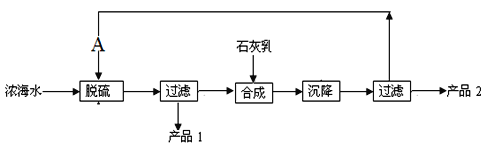
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为________,产品2的化学式为__________。1L浓海水最多可得到产品2的质量为____g。