题目内容
20.正确掌握化学用语是学好化学的基础.下列化学用语中正确的是( )| A. | 乙烯的结构简式为CH2CH2 | B. | 6个中子的碳原子的符号:12C | ||
| C. | Cl-的结构示意图: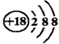 | D. | NaCl的电子式: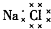 |
分析 A.乙烯的结构简式中没有标出其官能团碳碳双键;
B.质量数=质子数+中子数,元素符号的左上角为质量数;
C.Cl-核内有17个质子;
D.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷.
解答 解:A.乙烯分子中含有碳碳三键,其结构简式必须标出碳碳三键,乙烯的结构简式为CH2=CH2,故A错误;
B.6个中子的碳原子的质量数为12,该原子可以表示为12C,故B正确;
C.Cl-的核内有17个质子,核外电子数为18,离子结构示意图为: ,故C错误;
,故C错误;
D.氯化钠为离子化合物,阴阳离子需要标出所带电荷,氯化钠正确的电子式为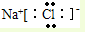 ,故D错误.
,故D错误.
故选B.
点评 本题考查了常见化学用语的书写判断,题目难度不大,注意掌握电子式、结构简式、结构式、元素符号的书写原则,明确离子化合物与共价化合物的电子式的区别,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
10.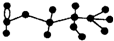 某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
①水解 ②加聚 ③取代 ④消去 ⑤银镜( )
 某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有①水解 ②加聚 ③取代 ④消去 ⑤银镜( )
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ①③④ | D. | ①④⑤ |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 常温常压下,22 g CO2中所含的共用电子对数为2NA | |
| C. | 25℃时,pH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001 NA | |
| D. | 密闭容器中加入一定量的H2和N2,反应生成1mol NH3时转移电子数小于3NA |
15.据美国《科学》杂志报道:在40GPa高压下,用激光器加热到1800K,制得具有高熔点、高硬度的二氧化碳晶体.下列关于该晶体的说法正确的是( )
| A. | 该晶体属于分子晶体 | |
| B. | 该晶体易汽化,可用作制冷材料 | |
| C. | 一定条件下,该晶体可跟氢氧化钠反应 | |
| D. | 每摩尔该晶体中含5 mol C-O键 |
5.常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是( )
| A. | pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
1.
 实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:
(一)乙酸正丁酯的制备
①在干燥的50mL三颈烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加3~4滴浓硫酸,摇匀,然后安装分水器投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水),温度计及回流冷凝管,加热冷凝回流反应.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL水洗涤,有机层继续用10mL 10% Na2CO3溶液洗涤至中性,再用10mL水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯注入50mL烧瓶中,常压蒸馏,收集125~127°C的馏分,得11.6g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)管口通入;
(2)写出该制备反应的化学方程式:CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O;
(3)步骤①中不断从分水器下部分出生成的水的目的是使平衡正向移动,提高反应产率;
(4)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2C03溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质;
(5)下列关于分液漏斗的使用叙述正确的是D(填字母);
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(6)该实验过程中,生成乙酸正丁酯(相对分子质量为116)的产率是80%.

 实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁醇,有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50mL三颈烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加3~4滴浓硫酸,摇匀,然后安装分水器投入1~2粒沸石.然后安装分水器(作用:实验过程中不断分离除去反应生成的水),温度计及回流冷凝管,加热冷凝回流反应.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10mL水洗涤,有机层继续用10mL 10% Na2CO3溶液洗涤至中性,再用10mL水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥.
③将干燥后的乙酸正丁酯注入50mL烧瓶中,常压蒸馏,收集125~127°C的馏分,得11.6g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填a或b)管口通入;
(2)写出该制备反应的化学方程式:CH3COOH+CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O;
(3)步骤①中不断从分水器下部分出生成的水的目的是使平衡正向移动,提高反应产率;
(4)产品的精制过程步骤②中,第一次水洗的目的是除去乙酸及少量的正丁醇,用饱和Na2C03溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质;
(5)下列关于分液漏斗的使用叙述正确的是D(填字母);
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的$\frac{2}{3}$
C.萃取振荡操作应如图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(6)该实验过程中,生成乙酸正丁酯(相对分子质量为116)的产率是80%.
2.如图,a和b均为金属棒,当电流计中指针发生偏转,下列说法正确的是( )


| A. | 电极a表面一定呈红色 | |
| B. | 电极b作负极 | |
| C. | 电极a或b其中有一极一定是金属铁 | |
| D. | 该装置能量转化形式为化学能转化为电能 |
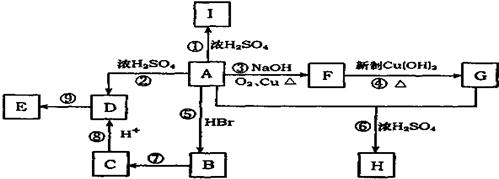 A
A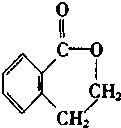 ;
; 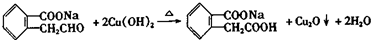 ;
;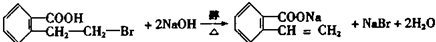 .
.