题目内容
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 常温常压下,22 g CO2中所含的共用电子对数为2NA | |
| C. | 25℃时,pH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001 NA | |
| D. | 密闭容器中加入一定量的H2和N2,反应生成1mol NH3时转移电子数小于3NA |
分析 A、标况下,四氯化碳为液态;
B、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含4mol共用电子对来分析;
C、溶液体积不明确;
D、合成氨的反应中,每生成1mol氨气转移3mol电子.
解答 解:A、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算,故A错误;
B、22g二氧化碳的物质的量n=$\frac{22g}{44g/mol}$=0.5mol,而1mol二氧化碳中含4mol共用电子对,则0.5mol二氧化碳中含2mol共用电子对,即2NA个,故B正确;
C、溶液体积不明确,故无法计算溶液中氢离子的个数,故C错误;
D、合成氨的反应中,每生成1mol氨气转移3mol电子,即转移3NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.将40mL 0.2mol/L NaOH溶液和20mL0.2mol/L的CH3COOH溶液混和,充分反应后蒸干并加强热,最终得到的固体是( )
| A. | Na2CO3 | B. | CH3COONa | ||
| C. | NaOH和CH3COONa的混合物 | D. | NaOH |
19.某同学按如图所示的装置进行试验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交换膜处SO42-从右向左移动.下列分析错误的是( )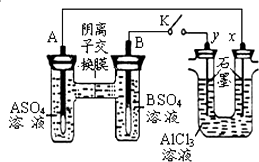

| A. | 金属活动性A强于B | |
| B. | 反应初期,y电极的电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 反应初期,x电极周围出现白色沉淀,后来电极附近沉淀溶解 | |
| D. | 电解一段时间后将AlCl3溶液倒入烧杯并搅拌可得到偏铝酸盐溶液 |
16. 科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
 科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )| A. | 反应①属于取代反应 | B. | W中至少含有1个手性碳原子 | ||
| C. | X、Y、W、Z都能与NaOH溶液反应 | D. | 可用溴水或FeCl3溶液鉴别X和W |
3.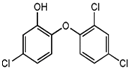 三氯生的化学名为2,4,4-三氯-2-羟基二苯醚(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生的化学名为2,4,4-三氯-2-羟基二苯醚(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
 三氯生的化学名为2,4,4-三氯-2-羟基二苯醚(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生的化学名为2,4,4-三氯-2-羟基二苯醚(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )| A. | 该物质与浓溴水可发生取代反应 | |
| B. | 物质的分子式为C12H6Cl3O2 | |
| C. | 该物质中所有原子不一定在同一平面上 | |
| D. | 该物质苯环上的一溴取代物有6种 |
13.煤、石油、天然气是重要的能源和化工原料,下列说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 石油产品都可用于聚合反应 | |
| C. | 水煤气是通过煤的液化得到的气态燃料 | |
| D. | 天然气是清洁燃料 |
20.正确掌握化学用语是学好化学的基础.下列化学用语中正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | 6个中子的碳原子的符号:12C | ||
| C. | Cl-的结构示意图: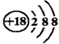 | D. | NaCl的电子式: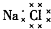 |
10.某校学生用化学知识解决生活中的问题,下列家庭实验中不合理的是( )
| A. | 用食醋除去暖水瓶中的水垢 | |
| B. | 用酒精清洗银器表面的氧化膜 | |
| C. | 用米汤检验含碘盐中的碘酸钾(KIO3) | |
| D. | 用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
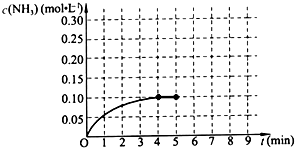 已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: