题目内容
12.(1)向饱和Na2CO3溶液中通入CO2,现象是有白色晶体析出,原因是①NaHCO3溶解度较小;②溶剂质量减小;③溶质质量增加.
(2)明矾在水溶液中的电离方程式为:KAl(SO4)2=K++Al3++2SO42-,实验室中若用明矾来制取Al(OH)3,则发生反应的离子方程式为:Al3++3NH3•H2O=Al (OH)3↓+3NH4+.
分析 (1)碳酸钠与CO2和水反应生成酸式盐NaHCO3,NaHCO3溶解度小于Na2CO3,并且反应生成的NaHCO3固体质量比原来Na2CO3多,溶剂质量减少,溶液中有浑浊出现,;
(2)明矾在水溶液中完全电离;实验室中常用明矾与氨水反应制取Al(OH)3.
解答 解:(1)碳酸钠与CO2和水反应生成酸式盐NaHCO3,NaHCO3溶解度小于Na2CO3,并且反应生成的NaHCO3固体质量比原来Na2CO3多,溶剂质量减少,溶液中有浑浊出现,
故答案为:有白色晶体析出;①NaHCO3溶解度较小;②溶剂质量减小;③溶质质量增加;
(2)明矾在水溶液中完全电离,离子方程式为KAl(SO4)2=K++Al3++2SO42-;实验室中常用明矾与氨水反应制取Al(OH)3,离子方程式为Al3++3NH3•H2O=Al (OH)3↓+3NH4+;
故答案为:KAl(SO4)2=K++Al3++2SO42-;Al3++3NH3•H2O=Al (OH)3↓+3NH4+.
点评 本题考查碳酸盐的性质及检验,题目难度不大,注意NaHCO3溶解度小于Na2CO3.

练习册系列答案
相关题目
2. 已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )
已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )
 已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )
已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中正确的是( )| A. | 还原性:Fe2+>I->Br- | |
| B. | 当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| C. | 原混合溶液中FeBr2的物质的量为6mol | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
3.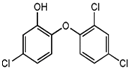 三氯生的化学名为2,4,4-三氯-2-羟基二苯醚(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生的化学名为2,4,4-三氯-2-羟基二苯醚(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
 三氯生的化学名为2,4,4-三氯-2-羟基二苯醚(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生的化学名为2,4,4-三氯-2-羟基二苯醚(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )| A. | 该物质与浓溴水可发生取代反应 | |
| B. | 物质的分子式为C12H6Cl3O2 | |
| C. | 该物质中所有原子不一定在同一平面上 | |
| D. | 该物质苯环上的一溴取代物有6种 |
20.正确掌握化学用语是学好化学的基础.下列化学用语中正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | 6个中子的碳原子的符号:12C | ||
| C. | Cl-的结构示意图: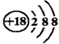 | D. | NaCl的电子式: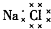 |
7.下述情况下物质的量可能不相等的是( )
| A. | 密度相等,等体积的NO和 C2H6 (g) | B. | 常温常压下,等体积的NO和 C2H6 (g) | ||
| C. | 等温条件下,等体积的NO和 C2H6 (g) | D. | 常温常压下,等质量的NO和 C2H6 (g) |
4.下列关于NH4Cl的说法中不正确的是( )
| A. | 氨气遇到HCl时,可以迅速反应生成NH4Cl | |
| B. | 0.5molNH4Cl中含有氢原子的质量是2克 | |
| C. | NH4Cl易溶于水,很稳定,受热不会分解 | |
| D. | 加热NH4Cl和碱的混合物,可以制取到氨气 |
13.下列除去杂质的方法中正确的是( )
| A. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| B. | 乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液 | |
| C. | 乙烷中混有乙烯,加入氢气在一定条件下充分反应 | |
| D. | 溴苯中混有溴,加入KI溶液后,用分液漏斗分液 |
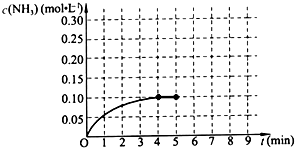 已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
已知工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: