题目内容
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226kJ·mol-1
N2(g)+2O2(g)2NO2(g) △H2=+68kJ·mol-1
N2(g)+O2(g)2NO(g) △H3=+183kJ·mol-1
脱硝反应△H=___,有利于提高NO平衡转化率的条件是___(写出两条)。
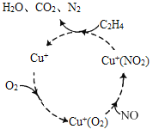
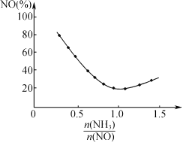
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如图所示。
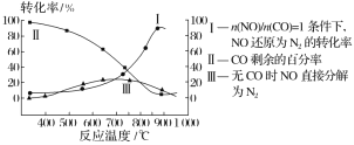
若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____。
【答案】-750kJ·mol-1 降温、升压、增大CO和NO的投料比等 该反应是放热反应,升高温度反应更有利于向逆反应方向进行
【解析】
(1)①CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226kJ·mol-1
②N2(g)+2O2(g)2NO2(g) △H2=+68kJ·mol-1
③N2(g)+O2(g)2NO(g) △H3=+183kJ·mol-1
根据盖斯定律可知反应①×2+反应②-反应③×2可得2CO(g)+2NO(g)2CO2(g)+N2(g),并可进一步计算反应热;提高NO的转化率,只需让平衡正向移动;
(2)升高温度,NO的分解率降低,说明反应逆向移动,该反应放热,据此分析作答。
(1)由分析可知反应①×2+反应②-反应③×2可得2CO(g)+2NO(g)2CO2(g)+N2(g),△H=-750kJ·mol-1;提高NO的转化率,只需让平衡正向移动,可选择降低温度、增大压强或增大CO和NO的投料比等方法;
(2)该反应为放热反应,升高温度,反应逆向移动,NO的分解率降低。