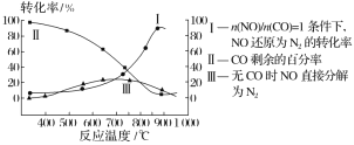
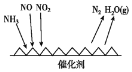
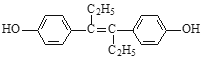
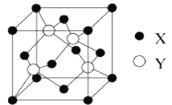
题目内容
【题目】①已知白磷和氯酸溶液可发生如下反应,将该反应进行配平:
______P4+_______HClO3+_______ ______=______HCl+____H3PO4
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
在该反应中30 mol CuSO4可氧化P4的物质的量是______mol.
【答案】3 10 ![]() H2O 10 12 1.5 mol
H2O 10 12 1.5 mol
【解析】
①根据氧化还原反应中得失电子数相等来配平氧化还原反应的方程式;
②根据转移电子守恒计算硫酸铜氧化白磷的物质的量。
①反应中P元素的化合价由0价升高到+5价,1个P4共升高4×5=20价,Cl元素的化合价由+5价降低到-1价,降低了6价,化合价升降最小公倍数是60,所以根据得失电子数目相等可知P4的系数是3,H3PO4系数是12,HClO3、HCl的系数是10,根据反应前后各种元素的原子个数相等,可知缺项物质是H2O,系数是18,则该反应的化学方程式为3P4+10HClO3+18H2O=10HCl+12H3PO4;
②Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4中部分P元素由0价降低到Cu3P中的-3价,部分P元素由0价升高到H3PO4中的+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11 molP4参加反应,其中5 mol的P4作氧化剂,60 mol硫酸铜作氧化剂,只有6 mol的P4作还原剂,所以30 mol硫酸铜转移电子物质的量=30 mol×(2-1)=30 mol,氧化白磷物质的量为:![]() =1.5 mol。
=1.5 mol。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:

回答下列问题:
(1)操作Ⅰ为:___________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中FeS发生反应的离子方程式:
(3)调节溶液pH所用物质X最好为(_______)
A.NaOH溶液 | B.氨水 | C.MnCO3固体 | D.盐酸 |
(4)滤渣Ⅰ为___________,滤渣Ⅱ为___________。
(5)沉锰的化学方程式为:______________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式:________。